
Cours
de sciences
appliquées à l’alimentation et à l’hygiène, enseignant :
M. P. Hardouin,
Sciences appliquées à l’alimentation et à l’environnement
Principaux Constituants de la Matière Vivante
L’être humain est un être vivant car il utilise de l’énergie chimique pour vivre. Cette énergie est sous forme d’ATP (Adénosine Tri Phosphate), c’est le "combustible" cellulaire de l'organisme.
L'unité énergétique internationale est le kJ (kilo Joule) mais on trouve encore des indications en kCal (kilo Calorie). 1 kJ=0,24 kCal ou 1 kCal=4,19 kJ.
L'apport énergétique alimentaire journalier doit être d'environ 11 300 kJ pour l'homme adulte et 8 400 kJ pour la femme adulte.
55% pour le métabolisme basal = fonctionnement des organes vitaux (respiration, circulation, activité cérébrale). On mesure le métabolisme basal en plaçant l'individu dans une enceinte thermorégulée et dans une situation de repos intellectuel et physique.
45% pour le métabolisme extra-basal :
travail musculaire : 25%
thermorégulation : 10%
activité dynamique spécifique (appareil digestif et urinaire) : 10%
L'ATP est d'origine alimentaire
Les aliments sont des complexes composés de glucides, lipides, protides, sels minéraux, vitamines, eau. Ce sont des molécules complexes ou macro-éléments de poids moléculaire important. Ces aliments vont devoir subir une digestion pour être transformées en molécules simples de faible poids moléculaire ou nutriments.
Aliments nutriments
Glucides oses (glucose)
Lipides acides gras
Protides acides aminés
Sels minéraux sels minéraux
Vitamines, H2O vitamines, H2O
Les enzymes digestifs (ou digestives) vont permettrent la digestion. Ils vont réaliser l’hydrolyse des aliments.
Les nutriments ainsi obtenus dans l’intestin grêle vont se retrouver dans le sang (directement ou via la lymphe) par le phénomène d’absorption. Le sang transportera ensuite les nutriments aux cellules composant l’organisme.
La cellule transforme les nutriments en énergie, c'est à dire en ATP. Cette transformation se fait en consommant de l’oxygène (dioxygène : O2) transporté également par le sang (via le système respiratoire).

Figure 1 : utilisation cellulaire de l'énergie potentielle des nutriments
De cette transformation résulte des déchets : CO2 et H2O. Le CO2 va repartir vers l’air via le sang et les poumons, l’H2O repart essentiellement vers l’extérieur via le sang et les reins.
o!o Les nutriments renferment de l’énergie sans en contenir eux-mêmes (ce ne sont pas des piles !). C’est ce que l’on appelle l’énergie potentielle.
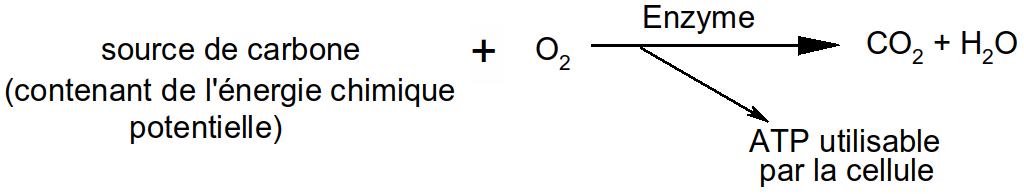
Figure 2 : catalyse enzymatique (schéma général)
Les enzymes déclenchent la réaction : elles ont un rôle de catalyseur.
On parle d’équilibre énergétique lorsque les entrées d’énergies sont égales aux dépenses énergétiques. Cela correspond à la quantité d’énergie dont l’organisme a besoin chaque jour pour fonctionner.
Ex : Une femme à droit quotidiennement à 8 400 kJ. Si elle mange pour 10 000 kJ, les 1 600 kJ excédentaires seront stockés. Lors d’un travail musculaire intense inhabituel les quantités entrées sont généralement insuffisantes et l’organisme puisera dans les réserves énergétiques.
Ex : Dans le cas d’une fracture, l’organisme va procéder à une synthèse osseuse pour élaborer un nouveau tissu osseux. Le tissu osseux est constitué de cellules osseuses (ostéocytes) constituées elles-mêmes de protides, lipides, glucides et calcium. Comme ces nutriments servent bâtir l’organisme, on les appelle nutriments bâtisseurs.
Ex : Lors d’une hémorragie il y a baisse de la volémie (volume sanguin). Le sang est constitué de plasma et de cellules sanguines (globules rouges et blancs, plaquettes). Après l’hémorragie il faut donc synthétiser de nouvelles cellules. Les globules rouges contiennent des molécules protéiques d’hémoglobine renfermant elle-même du Fer. Pour la synthèse de globules rouges il y a donc un besoin en Fer. Dans les conditions normales, un homme à besoin de 10 mg.jour-1 et la femme de 16,18 mg.jour-1 (besoin supérieur à cause des pertes menstruelles). Dans l’organisme, le Fer est stocké dans le sang et dans le foie.
Un enfant à des besoins énergétiques plus importants qu’un adulte.
Un adulte à des besoins énergétiques plus importants qu’un vieillard.
|
|
kilojoules |
|
|
Garçons 10 à 12 ans |
10 900 |
|
|
Adolescents 16 à 19 ans |
12 800 |
|
|
Filles 10 à 12 ans |
9 800 |
|
|
Adolescentes 16 à 19 ans |
9 700 |
|
|
ADULTES DE SEXE MASCULIN FRANÇAIS |
|
|
|
Activité physique habituelle |
11 300 |
|
|
Personnes ayant une activité physique importante |
12 500 |
|
|
ADULTES DE SEXE FEMININ FRANÇAIS |
|
|
|
Activité physique habituelle |
8 400 |
|
|
Personnes ayant une activité physique importante |
9 200 |
|
|
Femme enceinte, ajouter à la ration le 1er trimestre |
+ |
400 |
|
Femme enceinte, ajouter à la ration le 2ème et 3ème trimestre |
+ |
1 000 |
|
Femme qui allaite, ajouter à la ration |
+ |
2 100 |
|
Personnes âgées |
- |
10 à 20 % |
Tableau 1 : Apports énergétiques journaliers conseillés
La construction de l’organisme repose sur l’apport journalier en nutriments bâtisseurs : Glucides, Protides, sels minéraux et vitamines.
Ex : La diminution importante de la quantité d’acides aminés essentiels peut entraîner une maladie, fréquente dans les pays en voie de développement : la Kwashiorkor. La carence due à une alimentation céréalière pauvre en protéines, provoque chez l’enfant, après sevrage, des œdèmes des membres inférieurs et du visage, une fonte musculaire et une dépigmentation de la peau.
o!o L’alimentation devrait être composée de :
50 à 55% de glucides (édulcorants et non édulcorants)
12 à 15% de protides (animaux et végétaux)
32 à 35% de lipides (animaux et végétaux)
De plus il faut 1,5L d’H2O par jour, des sels minéraux et des vitamines : A pour la vision, B1 pour le système nerveux, B12 pour absorption du Fer, B9 pour la maturation de l’hémoglobine, B pour la fixation du Ca, E pour les fonctions de reproduction, K pour la coagulation du sang, PP pour la peau.

Figure 3 : rôles des nutriments (schéma général)
Certains des nutriments présentent un rôle catalytique (fonctionnel).
Ex : Ca2+ : coagulation du sang, Fe : fixation de l’O2 sur l’hémoglobine.
L’ensemble des réactions se déroulant dans l’organisme s’appelle le métabolisme. On distingue deux types de réactions :
Réactions de synthèse = anabolisme
Réactions de dégradation = catabolisme
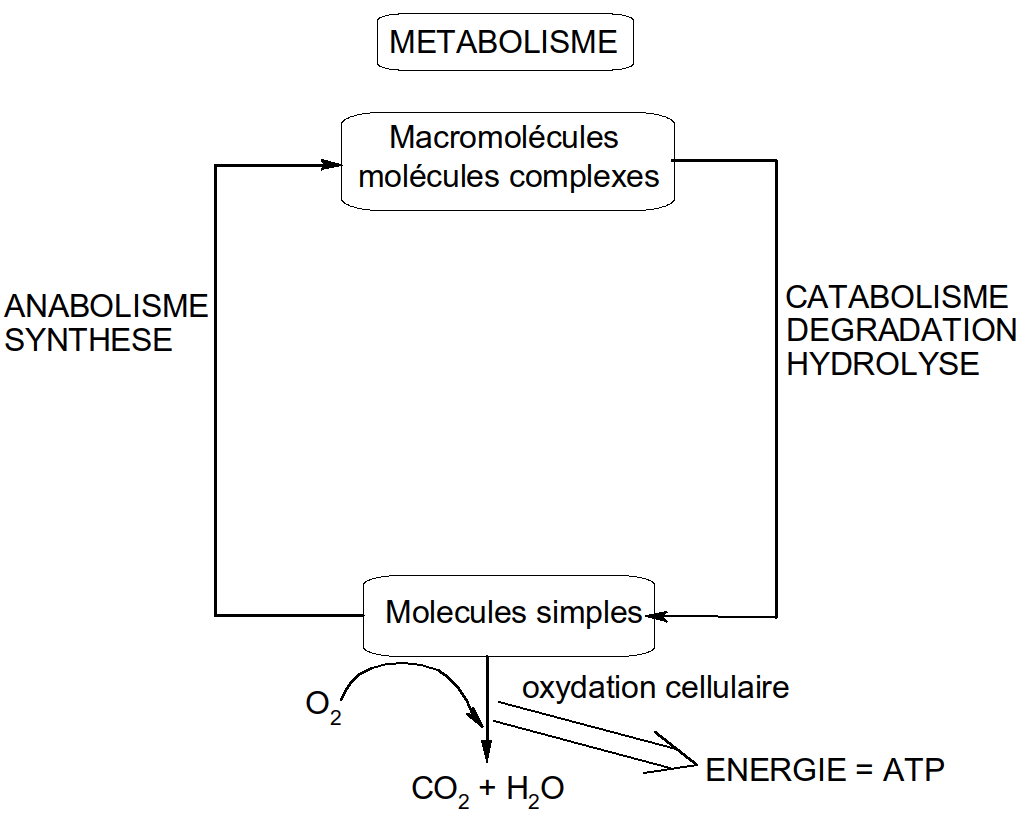
Figure 4 : le métabolisme (schéma général)
L’organisme est composé d’éléments organiques et d’éléments minéraux.
Éléments de la matière organique :
Carbone C 19,37% ≃ 20%
Hydrogène H 9,31% ≃ 10%
Oxygène O 62,81% ≃ 63%
Soufre S 0,64%
Phosphore P 0,63%
Azote N 5,14% ≃ 5%
Total 97,90% ≃ 98%
Les éléments atomiques de la matière organique représentent 98% de la matière chimique totale.
Éléments de la matière minérale :
Ca2+ + Cl- + Mg2+ + HCO3- + Fe2+ + K+ + PO43- + Na+ ≃ 2%
Principaux Constituants de la Matière Vivante
L’organisme est constitué de 60% d’eau, les 40% restants sont appelés matière sèche.
Ex : pour un homme de 70kg : teneur en H2O= 70x60%= 42L, et matière sèche = 70-42=28kg (car 1L d’H2O = 1kg).
La matière sèche est constituées de matière organique (95% des 40%) et de matière minérale (5% des 40%).
Ex : pour un homme de 70kg : matière organique= 28x95%= 26,6kg et matière minérale= 28-26,6= 1,4kg.

Figure 5 : cellules et répartitions hydriques
|
Eau corporelle totale 60% |
Matière sèche 40% |
|||
|
Liquide extra-cellulaire 20% |
Liquide intracellulaire 40% |
Matière organique 95% |
Matière minérale 5% |
|
|
Liquide interstitiel 16% |
Plasma 4% |
|||
Tableau 2 : répartition des liquides de l'organisme
Le milieu intérieur comprend les liquides extracellulaires : plasma et lymphe interstitielle.
Il faut que les entrées H2O= sorties H2O
Les sorties d’H2O (3,5 L.jour–1) :
Sueur, perspiration= perte d’eau naturelle au repos)
Urine
Liquide annexe (larmes)
Matières fécales (excréments)
Air expiré
Les entrées d’eau (3,5 L à prendre dans une journée) :
Boissons
Aliments
Métabolisme énergétique
C’est le solvant des principales bio-molécules, c'est à dire des substances ioniques ou non comme les protéines. Les ions et les protéines en solution contribuent à établir une certaine pression osmotique (= concentration ionique et protéique dans l’eau). Cette dernière est différente selon les milieux, c'est à dire quand la pression osmotique du liquide intracellulaire est différente de celle du liquide extracellulaire.
Poi < Poe hypertonie
Poi > Poe hypotonie
Les molécules dont la masse est sensiblement égale à l’eau, telle que le méthane (CH4), sont à l’état gazeux à température ordinaire ; seule l’eau et à l’état liquide. La molécule d’eau possède une grande cohésion liée à la structure même de la molécule. Chacun des atomes d’hydrogène partage une paire d’électrons avec un atome d’hydrogène. C’est la polarité des molécules d’eau et le fait qu’elles peuvent former des liaisons hydrogènes qui expliquent les propriétés particulières de l’eau.
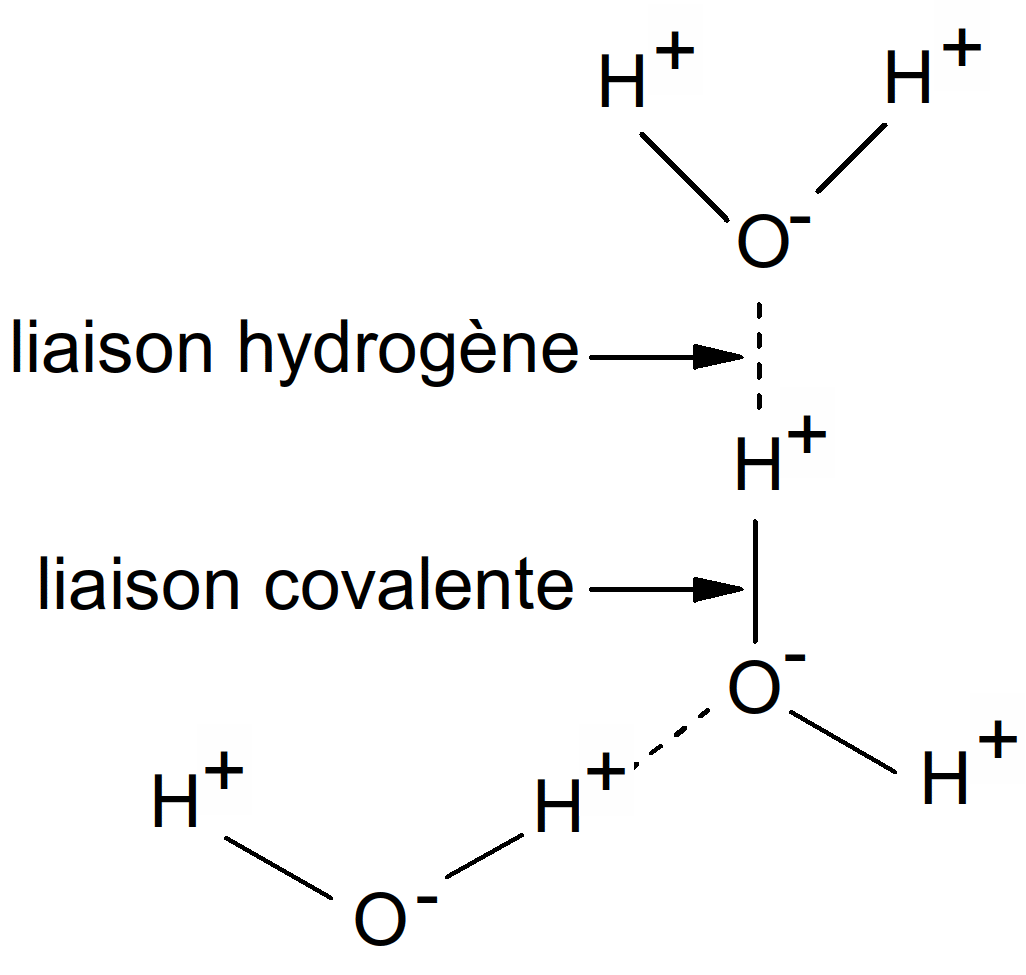
Figure 6 : liaison hydrogène
On en distingue 2 types :
Les cations : ions chargés positivement (Ca2+, Mg2+, Na+, K+)
Les anions : ions chargés négativement (Cl-, PO43-, HCO3-, SO42-)
|
composé |
Liquide intra-cellulaire |
Liquide extra-cellulaire |
||||
|
Lymphe |
Plasma |
|||||
|
mmol/L |
meq/L |
mmol/L |
meq/L |
mmol/L |
meq/L |
|
|
Sodium |
10 |
|
140 |
|
140 |
|
|
Potassium |
141 |
|
5 |
|
4.8 |
|
|
Calcium |
0.4 |
|
2.5 |
|
2.5 |
|
|
Magnésium |
29 |
|
1.5 |
|
0.9 |
|
|
Chlore |
4 |
|
103 |
|
101 |
|
|
Hydrogénocarbonate |
10 |
|
28 |
|
25 |
|
|
Phosphates |
75 |
|
4 |
|
4 |
|
|
Protéines (g/L) |
200 |
|
4 |
|
70 |
|
|
Glucose (mmol/L) |
1.1 |
|
5 |
|
5 |
|
|
Membrane cytoplasmique |
meq = mmol x nombre de charge |
|||||
Tableau 3 : Répartition des macro-éléments dans l’organisme
Aucun ions n’est en équilibre entre le milieu intra et extra-cellulaire. Le déséquilibre ionique contribue à l’établissement de la pression osmotique et permet les échanges cellulaires, c'est à dire les communication de la cellule avec son environnement.
|
Elément |
Symbole |
Fonctions particulières |
|
Calcium |
Ca (Ca2+) |
Composant des os et des dents. Intervient dans de nombreux processus physiologiques (contraction musculaire, coagulation du sang). |
|
Chlore |
Cl (Cl-) |
Anion le plus important dans la neutralité électrique |
|
Magnésium |
Mg (Mg2+) |
Composant des os. Rôle dans de nombreuses réactions chimiques (transmission neuromusculaire par exemple) |
|
Phosphore |
P (P3-) |
Composant des os et des dents. Présent dans l’ATP (Adénosine Tri Phosphate) |
|
Potassium |
K (K+) |
Principal cation intracellulaire, important dans les potentiels trans-membranaires et dans la contraction des cellules musculaires. |
|
Sodium |
Na (Na+) |
Principal cation extracellulaire, important dans les potentiels trans-membranaires. |
Tableau 4 : Rôles des macro-éléments
Ce sont des éléments présents en très petite quantité dans l’organisme. Il s’agit du cuivre, du cobalt, du manganèse, du zinc, du fer, du fluor, du silicium, de la silice, du molybdène, du chlore.
|
Elément |
Fonctions particulières |
|
Fer |
Entre dans la composition de l’hémoglobine, des enzymes |
|
Iode |
Intervient dans le fonctionnement de la thyroïde |
|
Fluor |
Intervient dans la composition des dents |
|
Zinc |
Nécessaire à la synthèse de l’hémoglobine |
|
Cuivre |
Entre dans la composition des enzymes cellulaires |
Tableau 5 : rôles des principaux oligo-éléments
Principaux Constituants de la Matière Vivante
La matière organique est composée de Carbone, Hydrogène Oxygène, Azote, Phosphore, Soufre.
|
Elément |
Symbole |
Fonctions particulières |
|
Carbone |
C |
Entre dans la composition des glucides, lipides, protides et acides nucléiques |
|
Hydrogène |
H |
Entre dans la composition des chaînes carbonées et de l’eau |
|
Oxygène |
O |
Entre dans la composition des glucide, lipides, protides, acides nucléiques, de l’eau. Gaz indispensable pour la respiration. |
|
Azote |
N |
Entre dans la composition des acides nucléiques et des protides |
|
Phosphore |
P |
Entre dans la composition des acides nucléiques |
|
Soufre |
S |
Entre dans la composition des acides aminés soufrés |
Tableau 6 : les éléments de la matière organique
Tous ces éléments entre dans la classe des atomes ou éléments atomiques
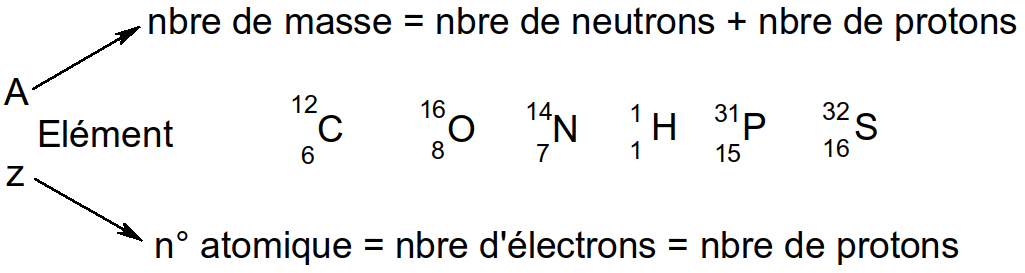
Figure 7 : l'élément atomique
Le noyau contient : les protons et les neutrons. Autour du noyau se trouvent les électrons qui constituent le nuage électronique. Ces électrons sont répartis en niveaux énergétiques ou couches électroniques : K (contient jusqu’à 2 électrons), L (8 électrons), M, N.
|
Nom de l’atome |
Symbole |
Nbre masse |
N° atomique |
Protons |
Electrons |
Neutron |
Valence |
Nuage électronique |
|
Carbone |
C |
12 |
6 |
6 |
6 |
6 |
4 |
K2L4 |
|
Hydrogène |
H |
1 |
1 |
1 |
1 |
0 |
1 |
K1 |
|
Oxygène |
O |
16 |
8 |
8 |
8 |
8 |
2 |
K2L6 |
|
Azote |
N |
14 |
7 |
7 |
7 |
7 |
3 |
K2L5 |
|
Phosphore |
P |
31 |
15 |
15 |
15 |
16 |
3 |
K2L8M5 |
|
Soufre |
S |
32 |
16 |
16 |
16 |
16 |
2 |
K2L8M6 |
Tableau 7 : les atomes de la matière organique
Pour acquérir la structure du gaz rare le plus proche, l’élément atomique partage un ou plusieurs électrons avec un autre élément atomique, et ce en fonction de sa valence. Entre ses 2 éléments, il pourra s’établir une liaison de covalence.
o!o Il existe un autre moyen d’acquérir la structure du gaz rare le plus proche : par gain ou perte d’électrons. En cas de perte d’électrons, la charge globale devient positive, on obtient un cation. En cas de gain, la charge devient négative, on a alors à faire à un anion.
Valence du Carbone = 4 4 liaisons de covalence possibles
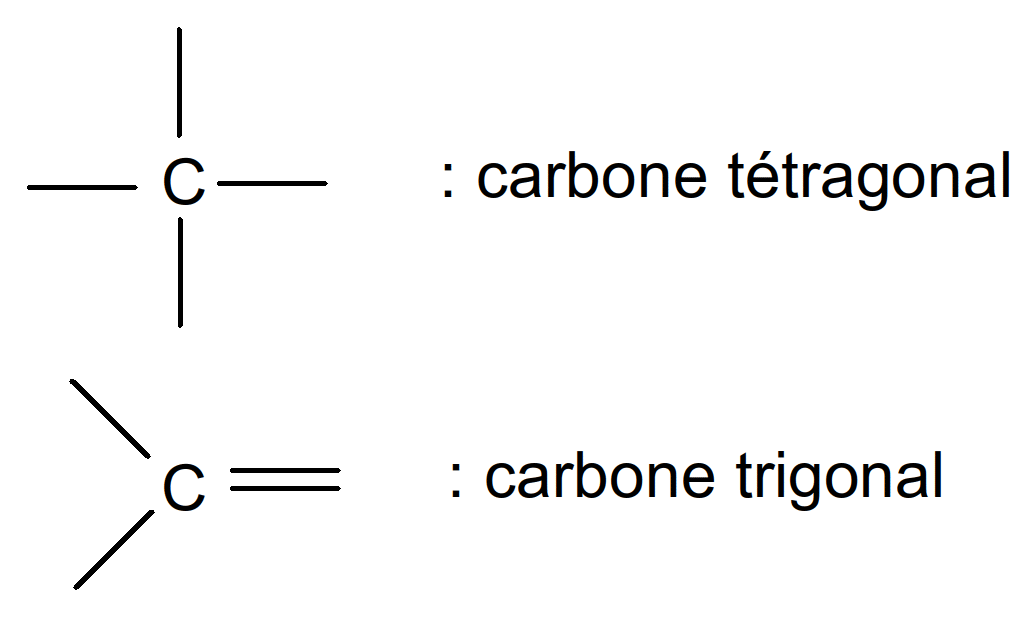
Figure 8 : valence du carbone
Lorsque les 4 valences du Carbone tétragonal portent des radicaux différents (R1 à R4), le carbone est dit asymétrique et se note C*.
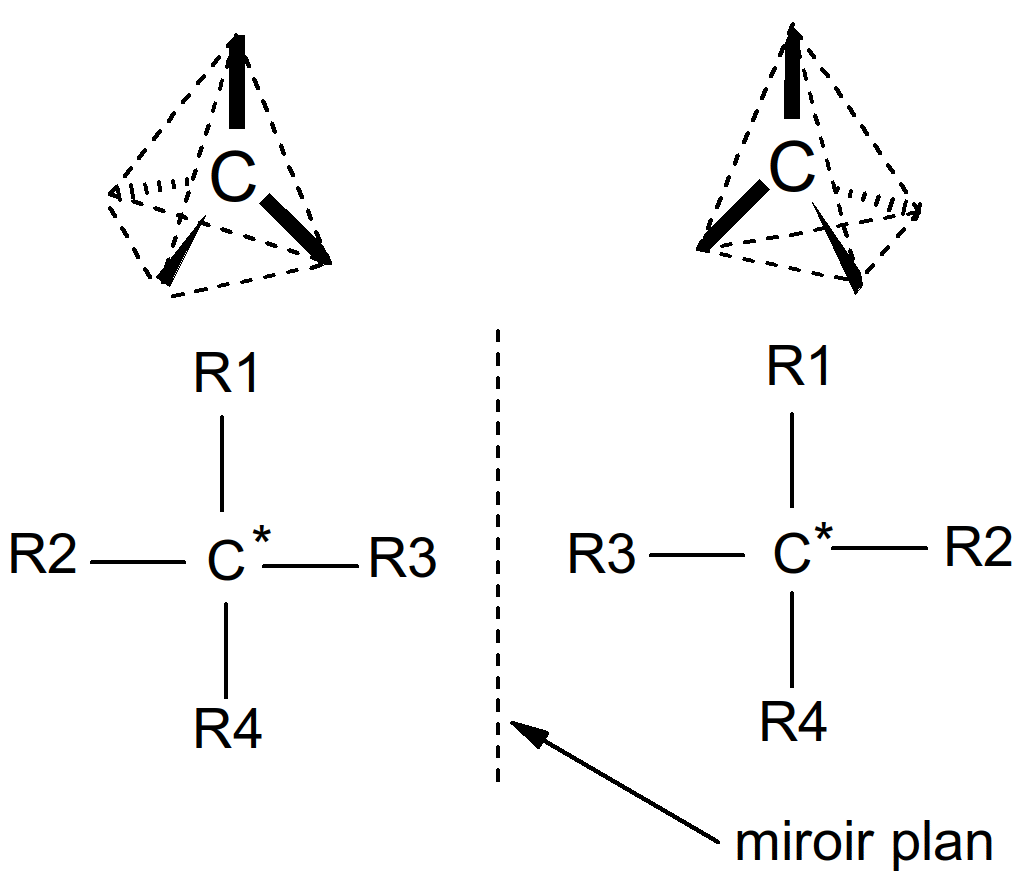
Figure 9 : asymétrie du carbone tétravalent
Les deux molécules de la "Figure 9 : asymétrie du carbone tétravalent" sont les images l’une de l’autre dans un miroir plan mais ne sont pas superposables : ce sont des énantiomères (ou isomères optiques). Pour vérifier l’existence d’énantiomère, on recherche la présence de carbone asymétrique. Deux énantiomères possèdent la même formule brute : ce sont des isomères avec un C*.
o!o 2 molécules non superposables sont appelées chirales.
Ex : Les 2 mains d’un individus sont chirales.
On appelle Radical un groupement fonctionnel n’intervenant pas dans la fonction principale.
|
Fonction organique |
schémas |
Remarques, définitions |
|
Alcool |
|
Les fonctions alcools sont des fonctions organiques pour lesquelles un groupe hydroxyle est porté par un atome de carbone tétragonal (lui-même lié à des atomes par 4 liaisons simples) On distingue les alcools I, II et III. |
|
Aldéhyde et cétone |
|
Les fonctions aldéhydes et cétones sont des fonctions organiques pour lesquelles le carbone fonctionnel porte un groupe carbonyle. Le carbone est trigonal. Selon la nature des radicaux, on distinguera la fonction aldéhyde ou la fonction cétone. |
|
Carboxylique |
|
Le carbone fonctionnel trigonal porte un groupe hydroxyle. Les molécules portant une fonction carboxylique présentent un caractère acide. |
|
Amine |
|
|
|
Ester |
|
|
|
Amide |
|
|
|
Ether-oxyde |
|
|
Tableau 8 : les principales fonctions organiques
Les glucides renferment C, H, O et accessoirement N et S. Le rapport H/O est toujours de 2/1. On distingue les molécules simples que l’on appelle Oses et les molécules complexes : les Osides.
Les oses sont des polyols (ou polyalcools), c'est à dire qu’ils possèdent plusieurs fonctions alcools (I et II) et un groupement carbonyle : fonction aldéhyde ou cétone.
Les oses porteurs d’une fonction aldéhyde sont appelés des aldoses
Les oses porteurs d’une fonction cétone sont appelés des cétoses
Un ose sera toujours défini par :
La fonction carbonyle
Le nombre (n) d’atomes de C contenu dans la molécule :
Si n=3 triose
Si n=4 tétrose
Si n=5 pentose
Si n=6 hexose
o!o Formule brute des oses : CnH2nOn ou Cn(H2O)n d’où l’ancien nom des glucides : hydrates de carbone.
Ex : si triose : C3H6O3, si hexose : C6H12O6
On appelle aldose un ose portant une fonction carbonyle aldéhydique sur le C n°1 (ou C1) et n-1 fonctions alcool dont une fonction alcool Iaire toujours portée par le C2.
Ex : Aldotriose C3H6O3
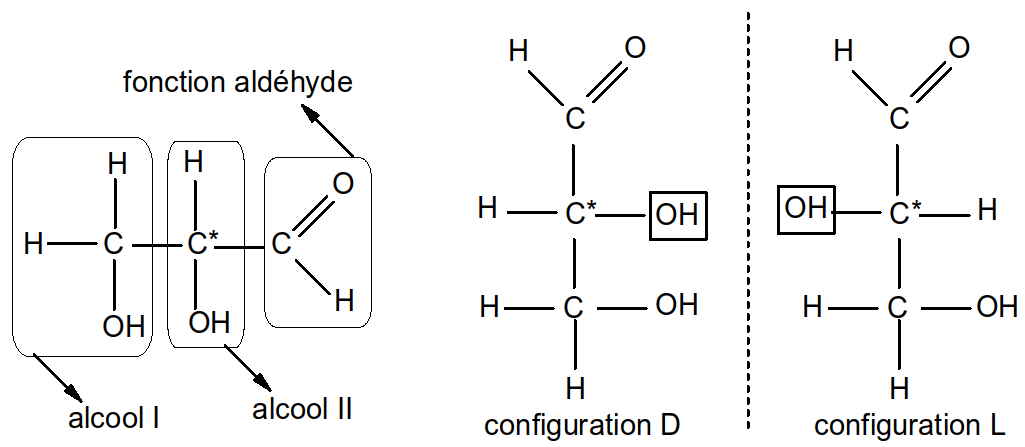
Figure 10 : glycéraldéhyde (aldotriose)
Ex : Aldotétrose C4H8O4
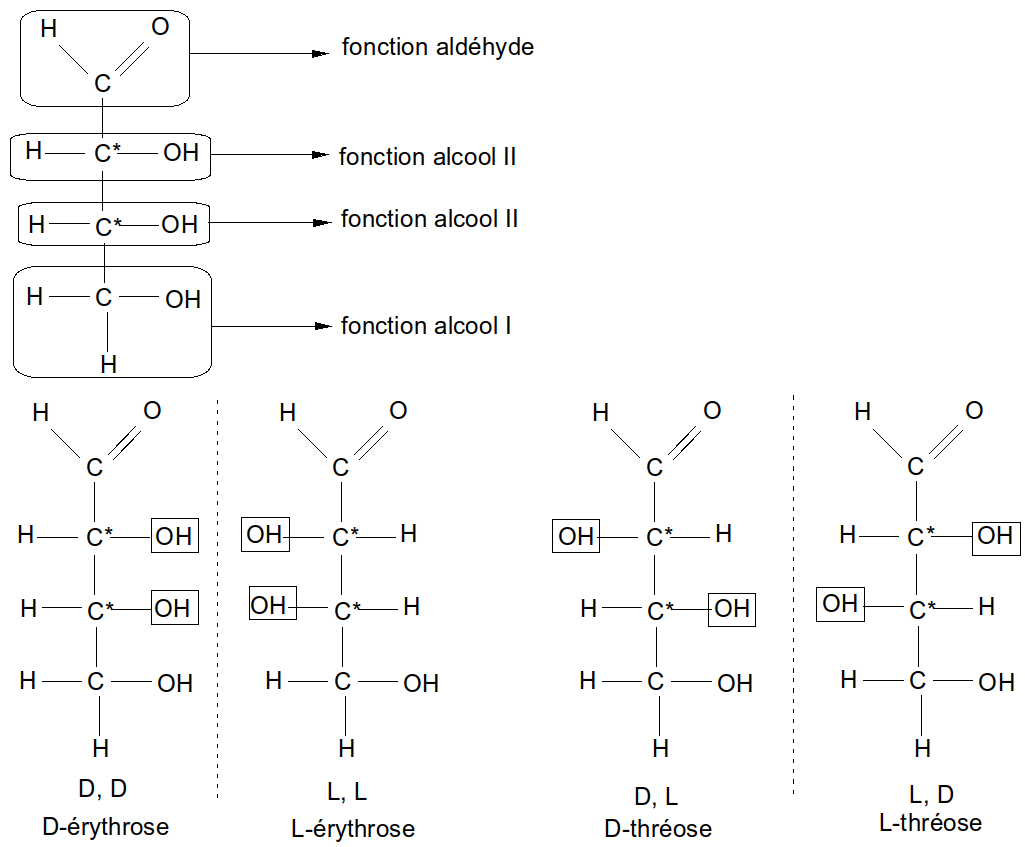
Figure 11 : aldotétroses
o!o x.C* 2x énantiomères
1.C* 2 énantiomères
2.C* 4 énantiomères
3.C* 8 énantiomères
4.C* 16 énantiomères
o!o Relation entre le nombre de C total et le nombre de C* :
x = n – 2 n = nombre d’atomes de C total
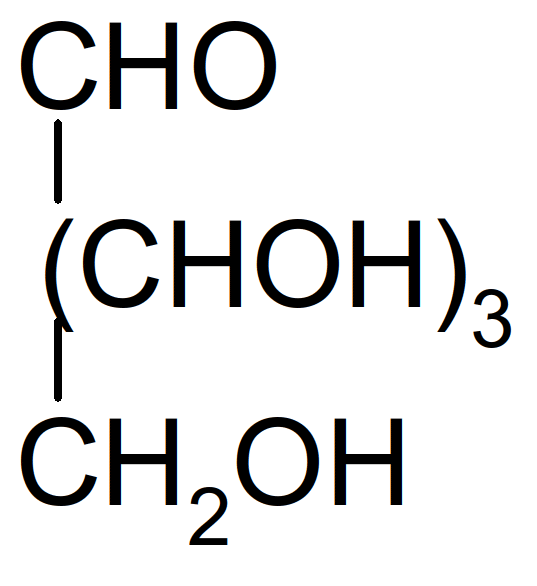
Figure 12 : Formule semi-développée d’un C5H10O5
L’aldose de la "Figure 12 : Formule semi-développée d’un C5H10O5" possède x=n-2=5-2=3 C*, c'est à dire 2x=23=8 énantiomères possibles.
o!o La plupart des oses naturels (aldoses ou cétoses) sont de la série D.
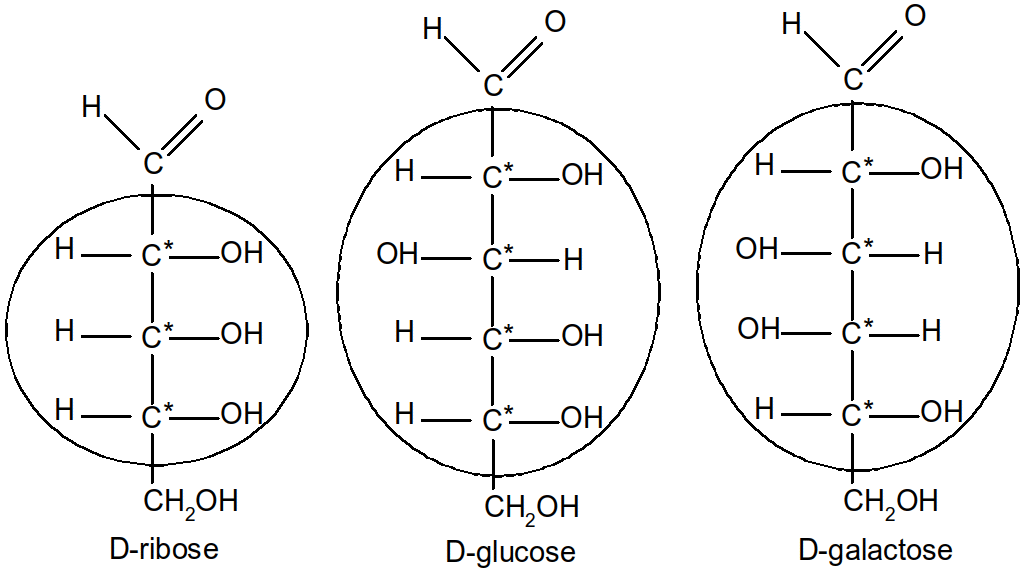
Figure 13 : aldoses remarquables
Parmi les aldoses importants nous avons le l'aldopentose ribose (constituant des acides nucléiques : ADN, ARN), et les aldohexoses glucose (Glc, faisant partie du diholoside saccharose) et galactose (Glc, présent dans le lait).
Les cétoses sont des oses simples portant comme fonction principale la fonction cétone :
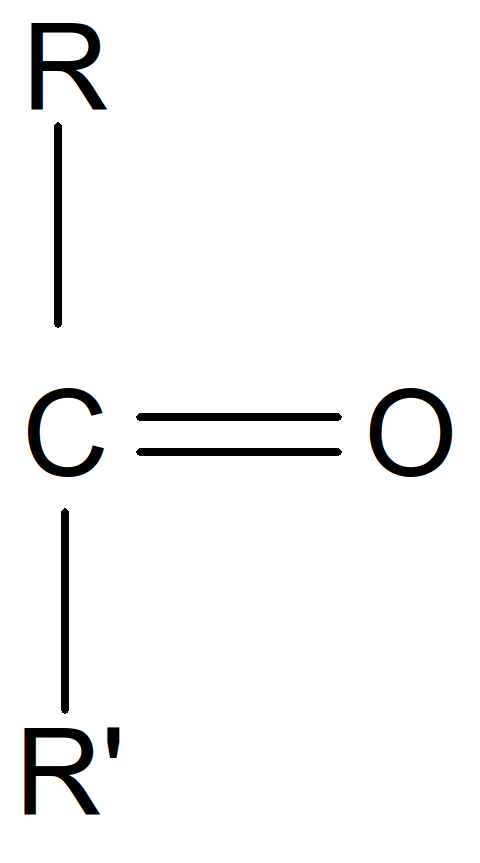
Figure 14 : fonction cétone
La fonction cétone est portée par le carbone n°2 (C2).
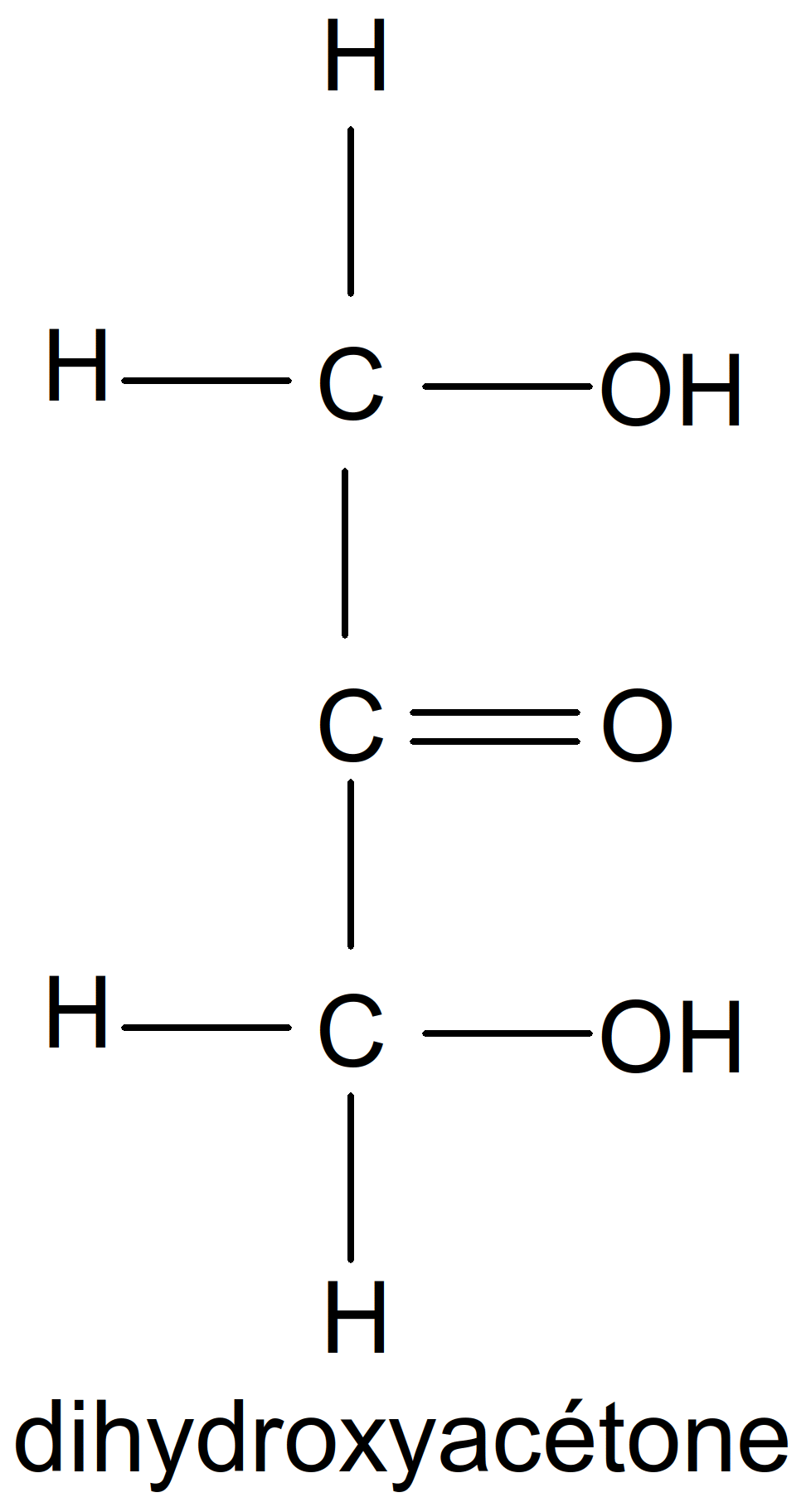
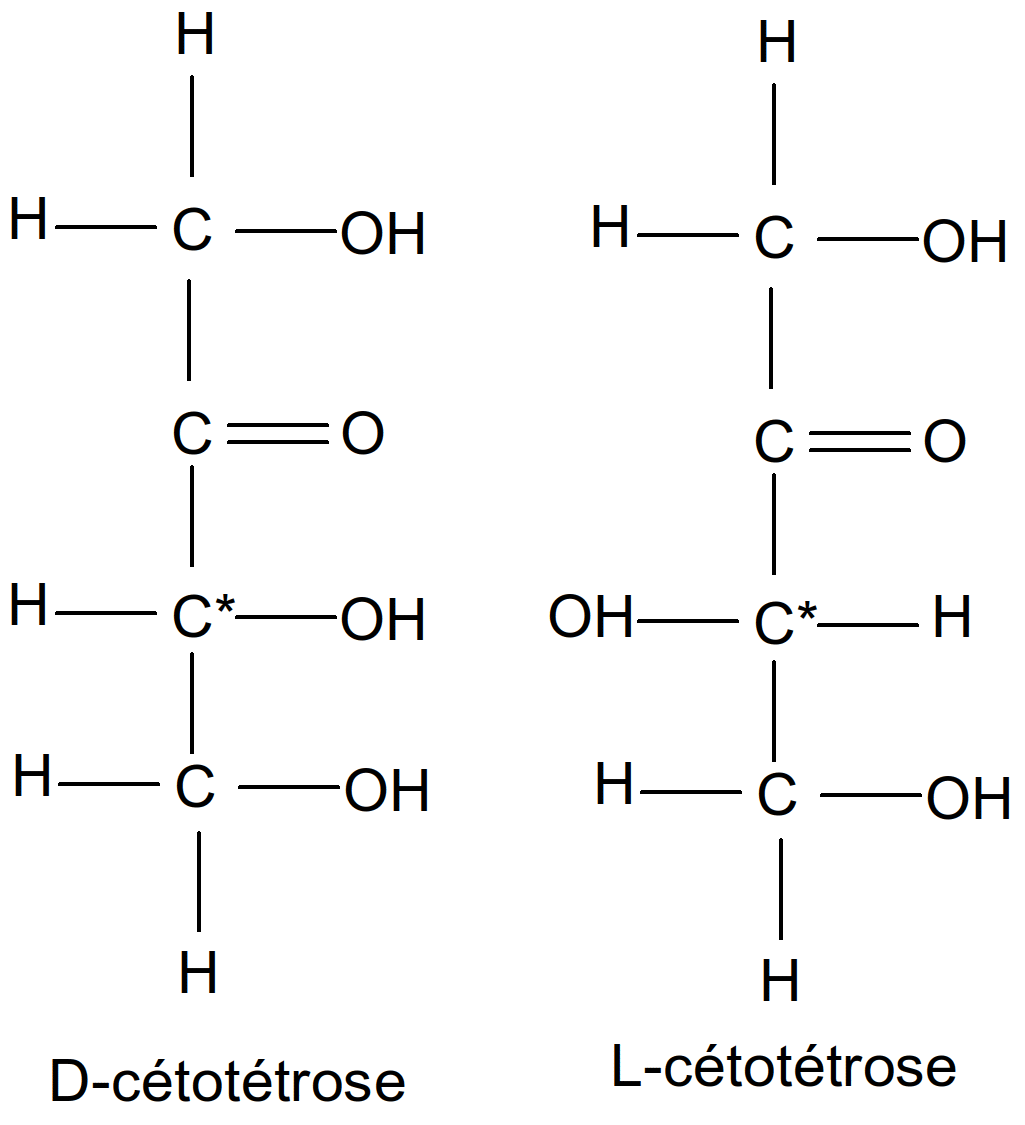
Figure 16 : cétotétroses
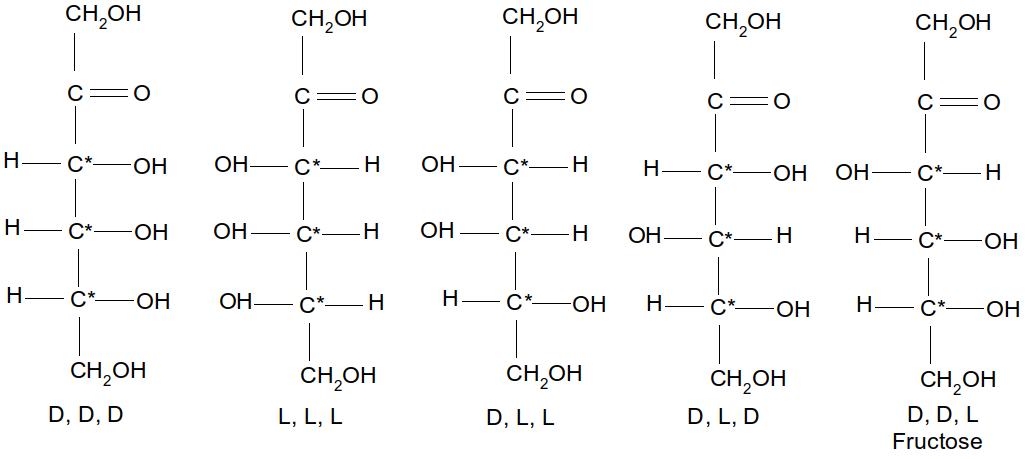
Figure 17 : cétohexoses dont le fructose (Fruc)
Dans le cas de la "Figure 17 : cétohexoses dont le fructose" nous avons 3.C*=23=8 isomères optiques.
o!o Les cétoses ne sont pas des sucres réducteurs on ne peux pas les mettre en évidence à l’aide de la liqueur de Fehling.
Jusqu’à présent nous avons écrit la formule des oses sous forme d’une chaîne linéaire. Mais cette représentation n’est pas satisfaisante car elle ne permet pas d’expliquer un certain nombre d’observations. Il fallait donc envisager l’existence d’un atome de carbone asymétrique supplémentaire et Tollens proposa une structure où le carbone 1 du glucose devient asymétrique après l’apparition d’un cycle formé par l’élimination d’une molécule d’eau entre la fonction aldéhydique et l’hydroxyle porté par le carbone 5 créant ainsi un pont osidique (voir complément sur les liaisons osidiques dans le chapitre consacré aux Osides).
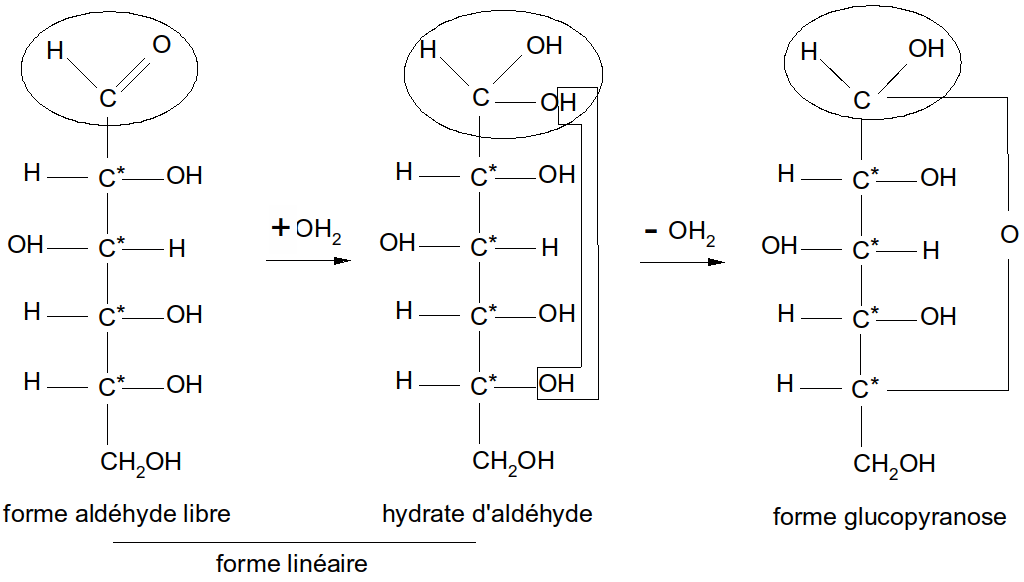
Figure 18 : passage du D-glucose de la forme linéaire à la forme glucopyranose
Le cycle hexagonal n’est pas plan : en raison des angles de valence de l’atome de carbone, le cycle pyranique prend une conformation en bateau ou en chaise. Cette cyclisation donne naissance à deux nouveaux isomères et du fait de la naissance d'un nouveau C*.
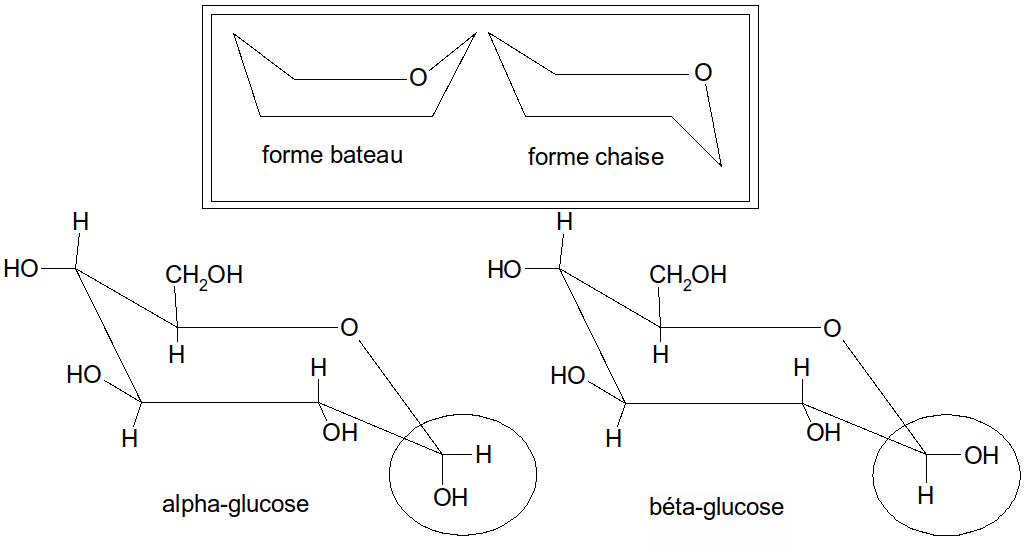
Figure 19 : formes bateau et chaise, et -glucose
Il y a deux possibilités de cyclisation donnant deux formes différentes : la forme pyranne (voir « Figure 18 : passage du D-glucose de la forme linéaire à la forme glucopyranose ») et la forme furanne.
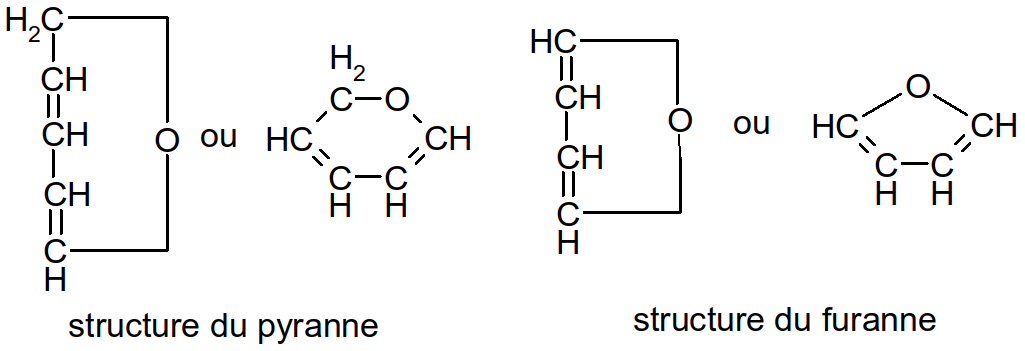
Figure 20 : structures des furanne et pyranne
On distingue les holosides (polymères d’oses) et les hétérosides (constitués de l’association entre une fraction osidique et une fraction soit lipidique, soit protidique, soit minérale). Nous ne parlerons ici que des holosides.
Selon le nombre d’oses constituant la chaîne, on parlera de :
Diholosides (2 oses : n = 2)
Oligoholosides (n ≤ 10)
Polyholosides (n > 10)
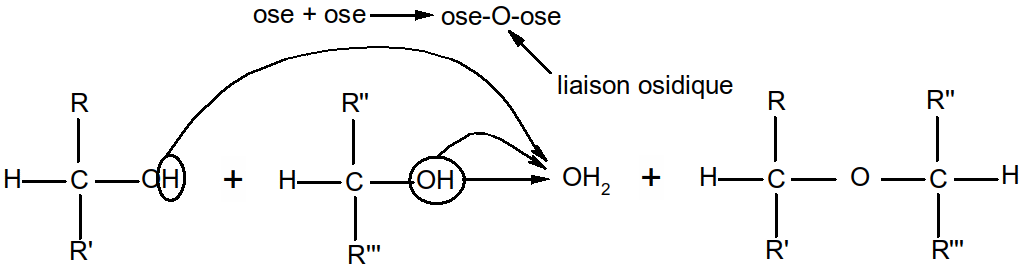
Figure 21 : la liaison osidique
Ex : La liaison s'appellera 1,4 ou 1,6 selon que les oses sont reliés entre eux par une liaison entre le C1 du premier ose et le C4 du second ou le C1 du premier ose et le C6 du second.
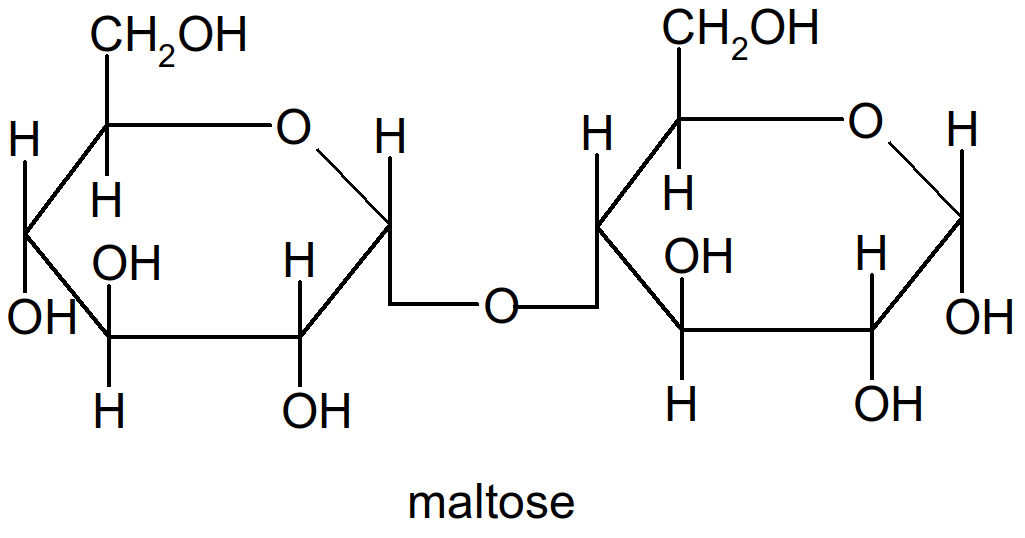
Figure 22 : molécule de maltose (2 glucoses reliés en 1,4)
o!o Les principaux diholosides sont le maltose (Glc 1,4 Glc) et le lactose (Gal 1,4 Glc) pour les diholosides réducteurs et le saccharose (Glc 12 Fruc) pour les diholosides non réducteurs.
Les polyholosides sont des polymères d'oses : enchaînement d'un nombre important d'unités identiques. Dans les cas d'études qui suivent, l'unité de base (ou monomère) est le glucose (Glc).
Il existe trois exemples principaux : dans le monde végétal nous avons l'amidon et le cellulose (fibre alimentaire) et dans le monde animal le glycogène.
Amidon et glycogène possèdent une structure proche car ils constituent la forme de réserve du glucose soit chez le végétal, soit chez l'animal. Ces 2 molécules dont constituées d'une polymérisation du glucose en 1,4 et en 1,6.
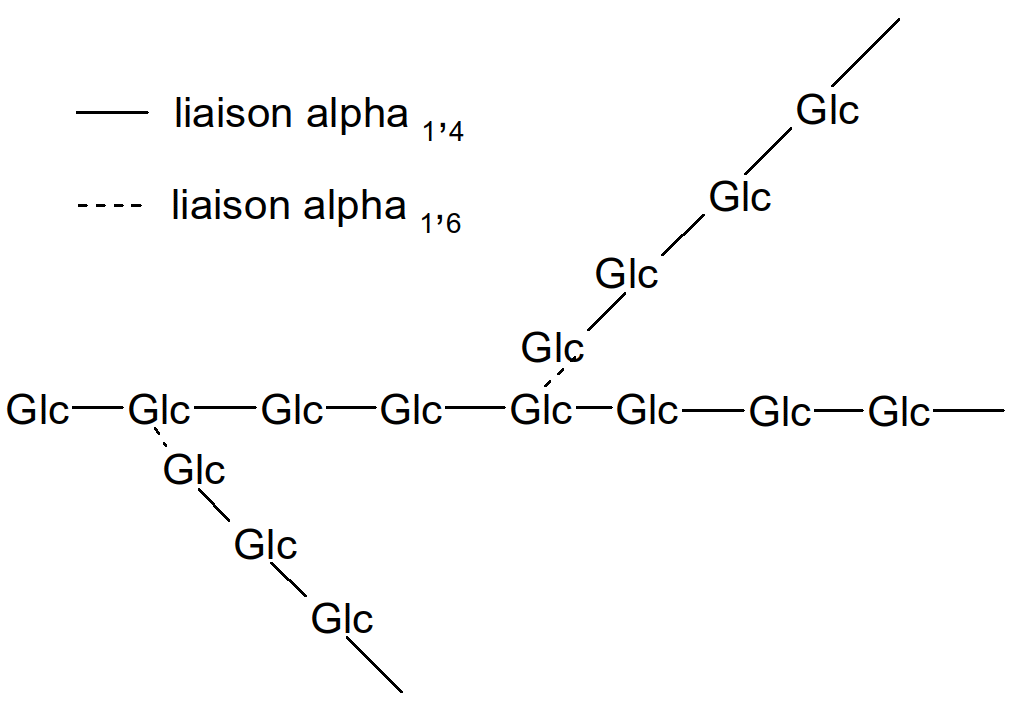
Figure 23 : amidon
o!o Formule brute de l'amidon : (C6H10O5)n
Ex : Comparons la masse molaire de la molécule d'amidon avec celle du glucose. Prenons une molécule d'amidon à 50 résidus Glc. Amidon : M(C6H10O5)50=162x50=8100 g.mol-1 macromolécule. Glucose : M(C6H12O6)=180 g.mol-1 molécule simple.
Pour la cellulose il s'agit d'un polymère de glucose en 1,4. Ces liaisons ne sont pas digérées par l'organisme humain.
Lors des processus de digestion alimentaire, l'amidon est tout d'abord dégradé en maltose par les amylases salivaires et pancréatiques. Ensuite, les maltases intestinales vont dégrader le maltose en glucose, glucose qui sera absorbé.
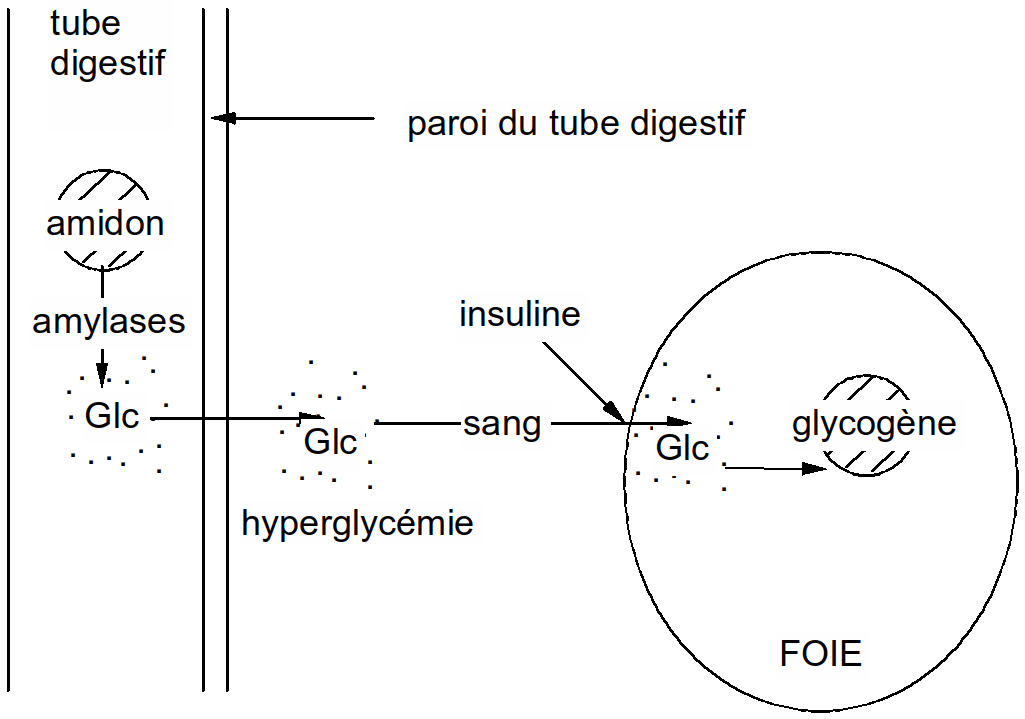
Figure 24 : schéma simplifié de la glycogénogenèse
Lors de besoin en glucose (le cerveau est un grand consommateur) il y a hydrolyse du glycogène en glucose afin d'augmenter la glycémie : c'est la glycogénolyse.
o!o L'amidon peut être mis en évidence grâce au test à l'eau iodée. En présence d'amidon, la solution vire au bleu nuit. S'il n'y a pas d'amidon dans la solution, cette dernière reste jaune pâle car l'iode possède cette couleur.
Les glucides jouent 2 rôles important :
un rôle énergétique où 1g de glucose représente 17kJ.
un rôle structural et fonctionnel : les protéines, conjuguées aux glucides leur donnent un rôle fonctionnel en entrant, par exemple dans la composition des membranes cytoplasmiques. Les glycoprotéines entrent également dans la composition d'hormones ou des marqueurs cytogénétiques responsables des groupes sanguins.
|
Sources alimentaires |
Sucres rapides |
Sucres lents |
|
sucre (blanc ou roux) |
saccharose |
|
|
confiture |
saccharose + fructose |
|
|
miel |
fructose + glucose |
|
|
fruit |
fructose + glucose |
pectine |
|
légumes (feuilles) |
glucose |
cellulose |
|
légumes (racines) |
saccharose + fructose + glucose |
cellulose |
|
légumes secs |
|
amidon + cellulose |
|
lait |
lactose |
|
|
farine |
|
amidon |
|
pain |
|
amidon |
|
pâtes/riz |
|
amidon |
|
pomme de terre |
|
Amidon + cellulose |
Ce sont des esters d'alcool et d'acide gras dont la propriété essentielle est l'insolubilité dans l'eau. Mais la solubilité est possible dans les solvants organiques tels que l'acétone, l'alcool, le chloroforme, l'éther.
Il existe 2 catégories de lipides :
Simples = acides gras
Complexes = lipides composés (glycérolipides, sphingolipides, céramides, cholestérol)
Dans l'industrie alimentaire, on désigne par nom de graisse un lipide solide à température ambiante et par nom d'huile un lipide liquide à température ambiante. En règle générale, huile = origine végétale alors que graisse = origine animale. Exception : la margarine.
Ce sont des acides carboxyliques composés d'une fonction carboxylique (R-COOH) + une chaîne hydrogénocarbonée. Le nombre total n d'élément C de la molécule donnera le nom de la molécule. n≥4 et n est toujours pair.
La chaîne hydrogénocarbonée contient ou non des double-liaisons. Un acide gras ne renfermant aucune double-liaison est appelé acide gras saturé (AGs). Un acide gras comportant une ou plusieurs double liaison est appelé acide gras insaturé (une double-liaison : AG mono-insaturé (AGmi), deux double-liaisons et plus : AG poly-insaturé (AGpi). Les AG poly-insaturés font essentiellement partie du domaine végétal.
Ces AG poly-insaturés constituent les AG essentiels, c'est à dire les AG nécessaires au fonctionnement de l'organisme mais celui-ci est incapable de les produire lui-même, donc il faut les lui apporter par voie alimentaire.
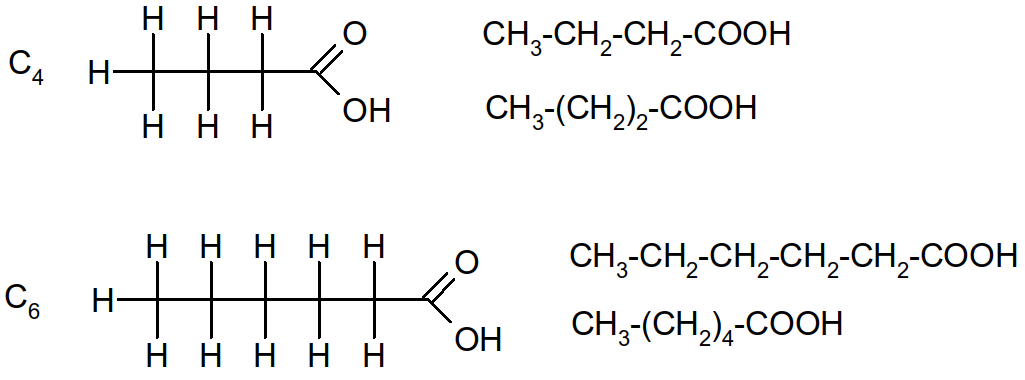
Figure 25 : formules développées et semi-développées d'acides gras en C4 et C6
o!o Formule générale des acides gras saturés : CH3-(CH2)n-2-COOH ou CnH2nO2
Ex : acide palmitique (n=16) : formule brute = C16H32O2 et semi-développée = CH3(CH2)14-COOH
Cn,xy,z…n désigne le nombre de C de l'acide gras, x désigne le nombre de double-liaisons contenus dans la molécule, y,z… désignent les positions des doubles-liaisons. La double-liaison est placée après l'atome de C indiqué. La numérotation des C commence avec C1 porteur de la fonction carboxylique.
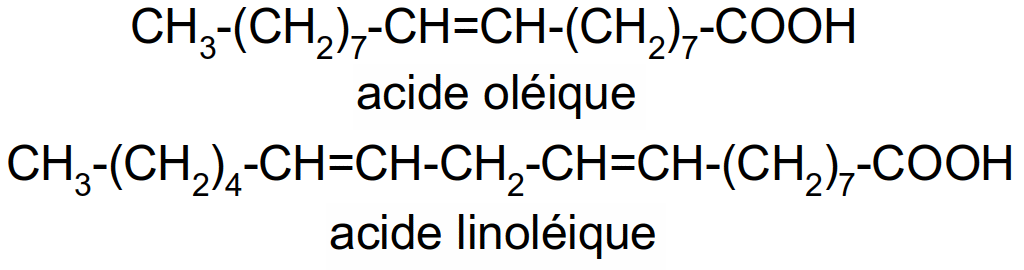
Figure 26 : acide oléique (C18,19) et linoléique(C18,29,12)
Ex : Trouvez les formules développées et semi-développées de l'acide linolénique (C18,39,12,15), de l'acide arachidonique (C20,45,8,11,14).
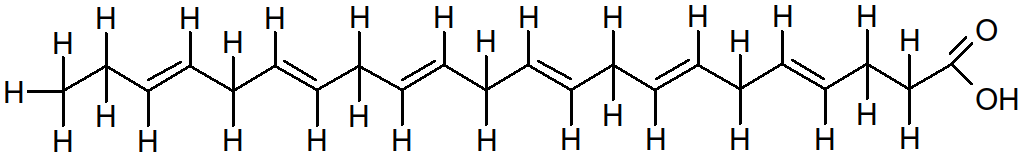
Figure 27 : acide docosahexaenoïque (C22,64,7,10,13,16,19).
o!o Formule générale des acides gras insaturés : CnH2n-2xO2
o!o n<10 liquide à température ambiante, n>10 solide à température ambiante
o!o Le nombre de double-liaisons diminue le point de fusion. En conséquence, les AGmi et les AGpi sont largement représentés dans les huiles et rendent ces dernières liquides à température ambiante. A l'inverse, les graisses animales sont solides à température ambiante du fait de la teneur importante en AGs.
Lipides animaux : saindoux, beurre, viandes, œufs, poissons, lait entier
Lipides végétaux : AGmi et AGpi : huiles, fruits oléagineux (soja)
Ce sont des esters de glycérol et d'acides gras (estérification = résultat de la polymérisation entre une fonction alcool et une fonction acide).
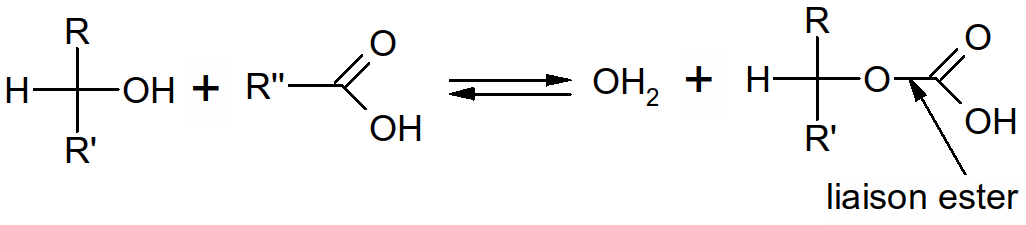
Figure 28 : formation d'une liaison ester
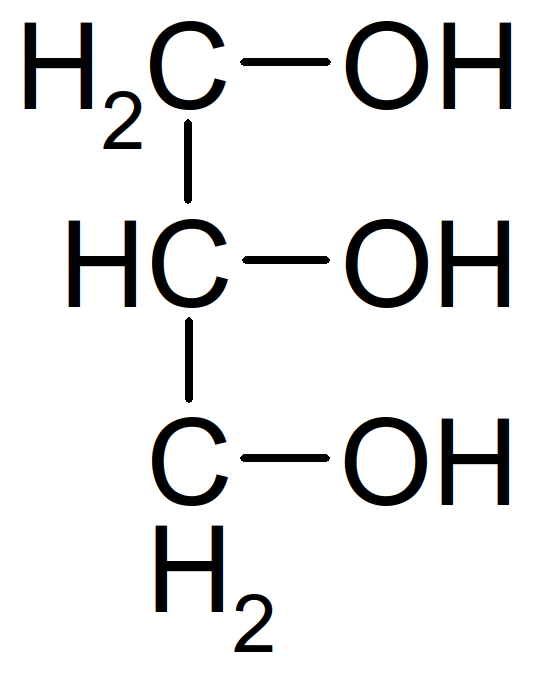
Figure 29 : formule du glycérol (glycérol=alcool=triol)
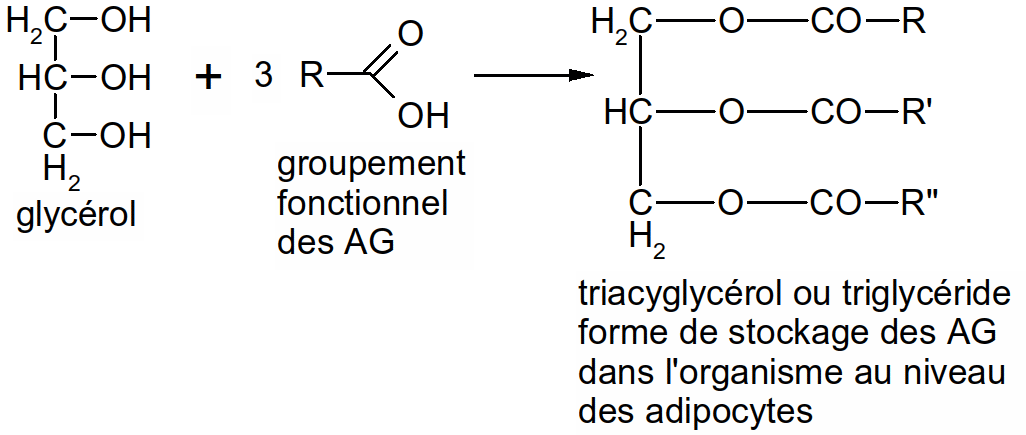
Figure 30 : formation des triglycérides
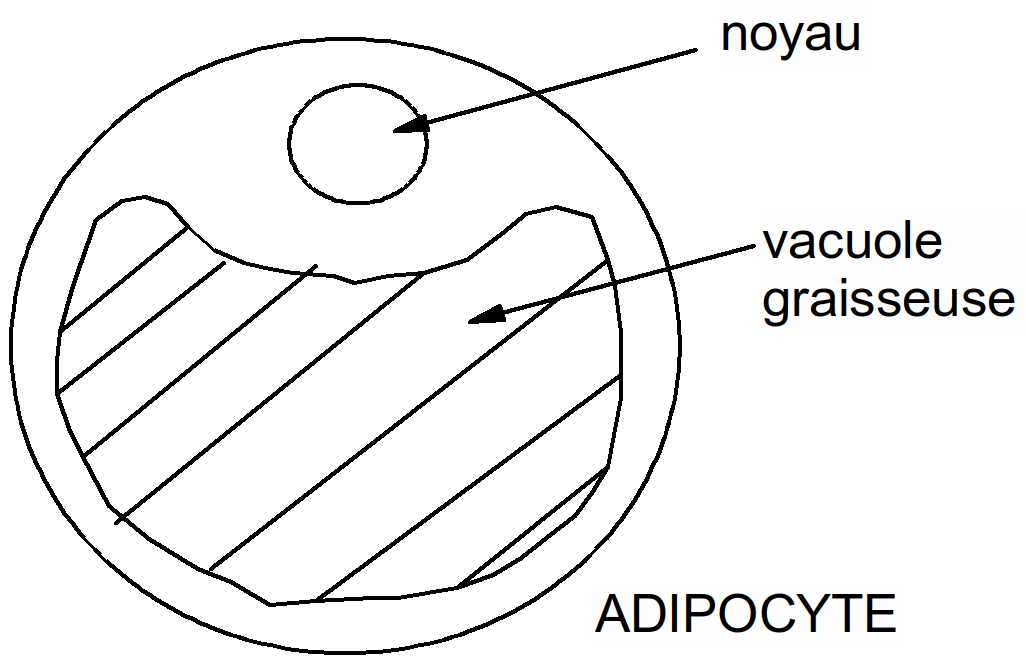
Figure 31 : la graisse est stockée dans des cellules spécialisées
o!o Il existe 2 formes de stockage de l'énergie dans l'organisme :
les triglycérides stockés dans les adipocytes
le glycogène stocké dans le foie ou les muscles
3ème forme plus secondaire :
les protides au niveau des muscles (le foie utilise les acides aminés comme source d'énergie)
o!o 1 glycérol + 1 AG 1 monoglycéride + H2O, 1 glycérol + 2 AG 1 diglycéride + 2 H2O
Les glycérolipides ne peuvent pas circuler librement dans le sang car il ne peut pas transporter quelque chose d'insoluble dans le plasma. Ils sont donc transportés dans le sang via des lipoprotéines. Il existe plusieurs types de lipoprotéines :
Chylomicrons : chargés des véhiculer dans la lymphe les triglycérides absorbés par voie intestinale lors de la digestion.
VLDL = lipoprotéines de très faible densité
LDL = lipoprotéines de faible densité
HDL = lipoprotéines de forte densité
Ce sont des molécules dérivant des acides phosphatidiques.
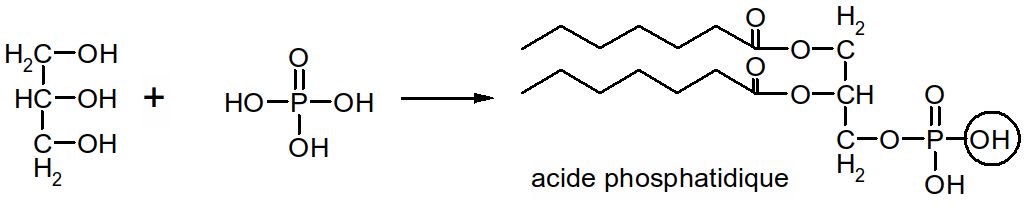
Figure 32 : formation de l'acide phosphatidique
On peut encore fixer de la choline sur le dernier OH de l'acide phosphatidique.
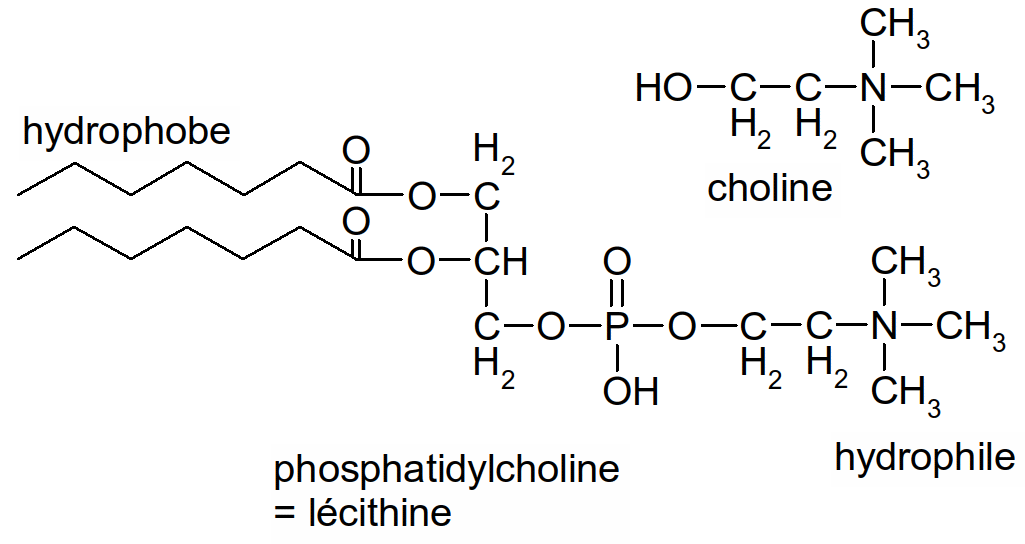
Figure 33 : la lécithine
Les phospholipides entrent dans la composition des membranes cytoplasmiques des cellules.
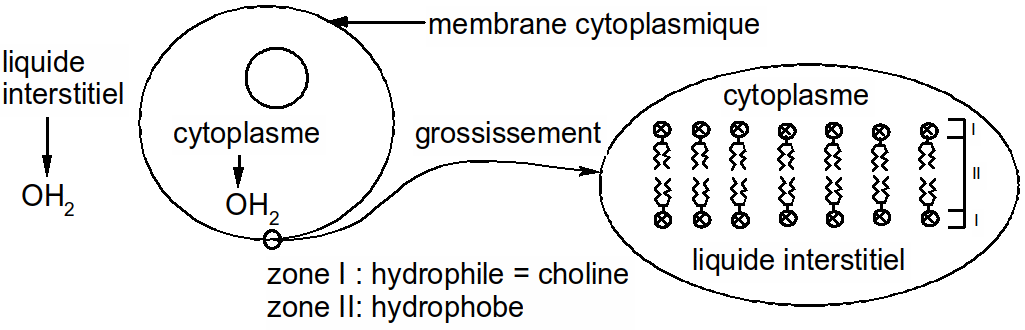
Figure 34 : phospholipides et membrane cytoplasmique
structural car les lipides entrent dans la composition des membranes cytoplasmiques
énergétique car 1 g de lipides = 38kJ et que les lipides sont stockés sous forme de triglycérides.
fonctionnel car certaines molécules telles que le cholestérol entre dans la composition de certaines hormones appelées stéroïdiennes (ex : hormones sexuelles).
Ce sont des molécules organiques contenant C, H, O et surtout N
2 types :
molécules simples : acides aminés
molécules complexes : polymères d'acides aminés c'est à dire composés d'un assemblage d'acides aminés.
Les acides aminés sont des acides car ils portent une fonction carboxylique (R-COOH). Ils portent aussi une fonction amine (R-NH2). En fait ce sont des amines II.
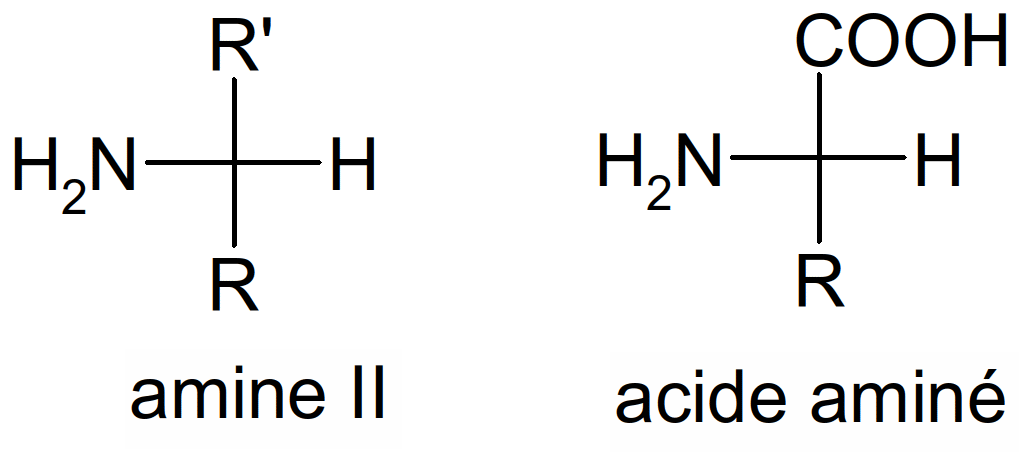
Figure 35 : amine II et acide aminé
Dans la nature il existe plus de 20 radicaux (R) différents, c'est à dire qu'il existe 20 acides aminés
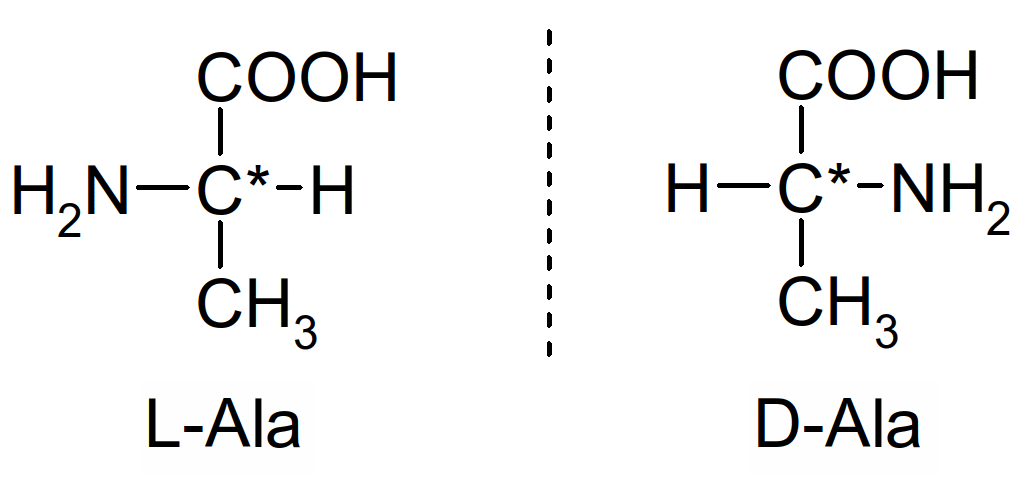
Figure 36 : l'acide aminé alanine (Ala)
Dans la nature on ne trouve que des acides aminés de configuration L. Tous les acides aminés portent au moins un C* sauf la glycine (Gly) = glycocolle :
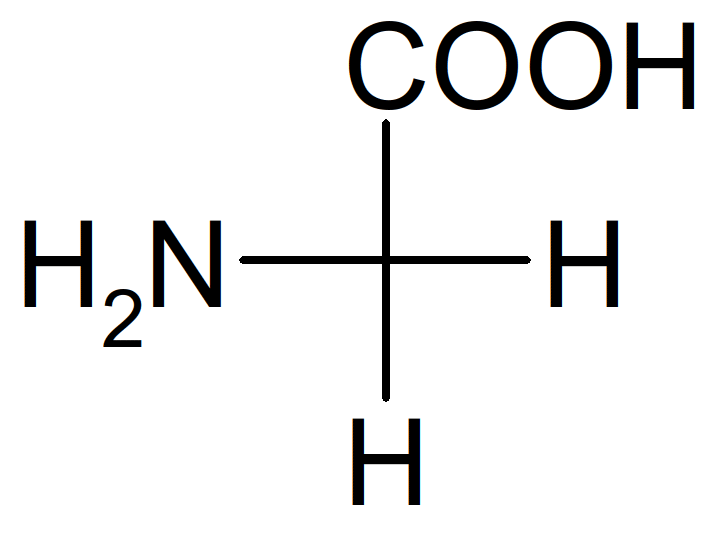
Figure 37 : glycine (Gly)
Parmi ces 20 acides aminés, certains sont appelés acides aminés indispensables (cf cours d'alimentation). Un acide aminé indispensable c'est un acide aminé qui n'est pas synthétisé par le corps humain. Il faut donc lui apporter par voie alimentaire sinon il y a un risque de dénutrition.
Toutes les réactions de condensation ( = réaction d'isomérisation) s'effectuent par formation d'une molécule d'eau (H2O ⇔ H+ + OH-).
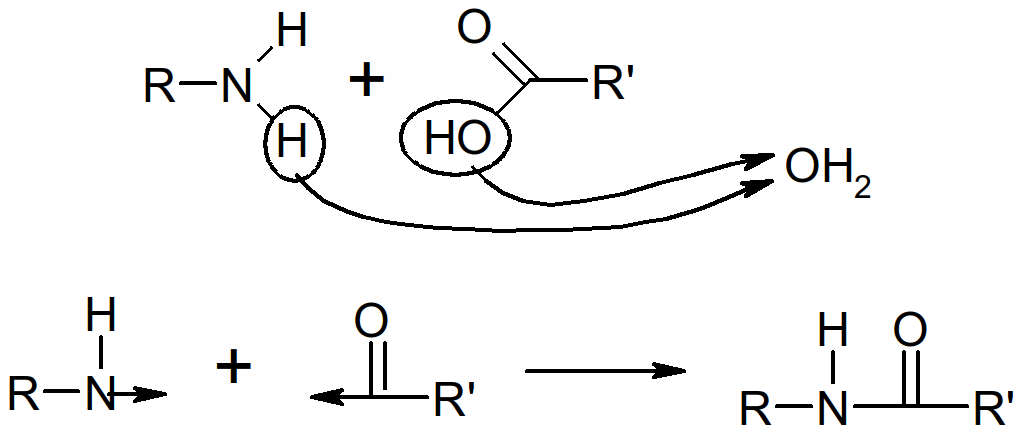
Figure 38 : liaison peptidique
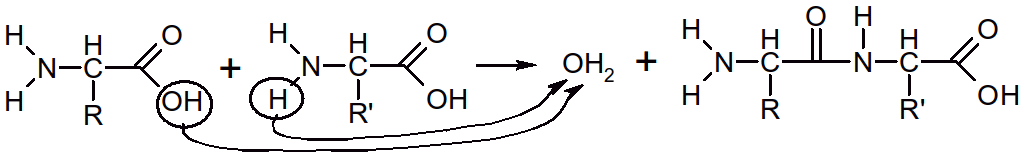
Figure 39 : formation d'un dipeptide
On peut augmenter le taux de polymérisation (tri, polypeptide) du côté du groupement COOH libre.
Une protéine est un polymère d'acides aminés c'est à dire que c'est une macromolécule composée de l'association de nombreuses unités de base (= acide aminé) réunis entre eux par des liaisons peptidiques.
Lorsque le nombre (n) d'acides aminés :
n<10, on parle d'oligopeptides
10≤n≤80, on parle de polypeptides
n>80, on parle de protéines
Lorsqu'on regarde la masse molaire des acides aminés on constate qu'elle est ≃ 100 g.mol-1. La masse molaire des protéines est très élevée d'où l'appellation de macromolécule pour les protéines.
Une protéine sera définie par sa structure Iaire : séquence en acides aminés de la protéine. A partir d'un pool d'acides aminés, l'organisme est capable de créer une protéine. L'information qui permet de conduire à la structure Iaire de la protéine est contenue dans la molécule d'ADN.
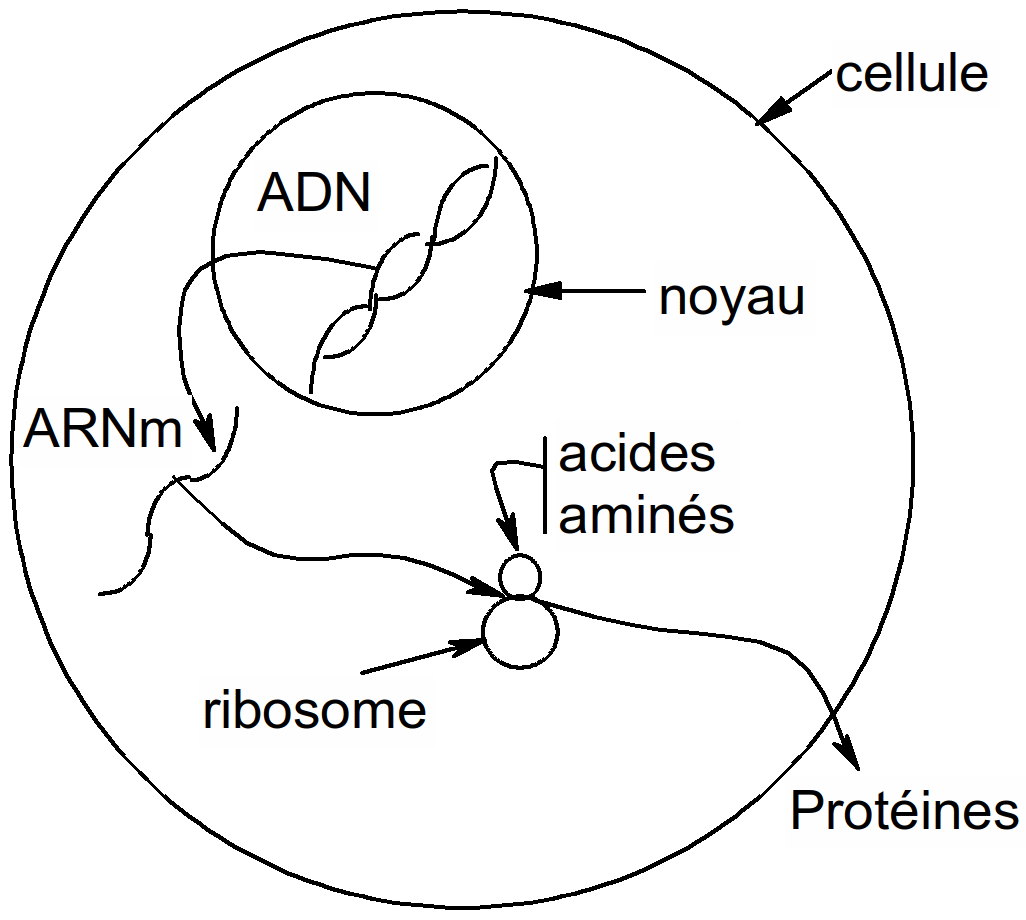
Figure 40 : synthèse protéique (schéma simplifié)
Structure IIaire : Il existe des interactions entres les différents radicaux des acides aminés de la chaîne peptidique qui font que la protéine prendra une forme d'hélice ou une forme de feuillet plissé.
Structure IIIaire : correspond à un aspect tridimensionnel de la protéine. La protéine ne présente pas une structure plane mais une conformation dans l'espace.
Structure IVaire : correspond à l'association de plusieurs sous-unités protéiques pour constituer une molécule complexe fonctionnelle. Ex : l'hémoglobine (pigment chargé du transport de l'O2) présente une structure protéique comportant 4 sous unités (1, 2, 1, 2) chez l'adulte.
Test du Biuret : met en évidence les liaisons peptidiques
Thermocoagulation : La chaleur a tendance à faire prendre en masse les protéines on a à faire à une dénaturation protéique.
Ex : L'œuf dur. Dans le blanc ovalbumine (protéine soluble). Si on chauffe, on obtient un solide (les protéines se transforment).
Ex : La gélatine. La collagène de la viande, lorsqu'on la fait bouillir, donne de la gélatine.
Test xanthoprotéique : la solution protéique est mise en présence d'HNO3 puis chauffée. On obtient une coloration jaune qui additionnée de KOH devient orange. La coloration orange obtenue est spécifique des acides aminés aromatiques présents dans la protéine (ex : phénylalanine, tryptophane).
Précipitation par l'acide trichloracétique
On distingue les holoprotéines et les hétéroprotéines
Les holoprotéines : selon leur structure on distingue les protéines fibrilaires ou les protéines globulaires (ex : hémoglobine). Les holoprotéines sont exclusivement constituées d'acides aminés.
Les hétéroprotéines : sont constituées d'une fraction protéique associée à un groupement minéral (ex : phosphoprotéines dans les os) ou à une autre molécule organique (ex : glycoprotéines marqueurs de groupes sanguins, lipoprotéines LDL, HDL chargés de transporter le cholestérol dans l'organisme.
Problème de LDL-cholestérol : il a des récepteurs dans les artères formation de plaques d'athérome athérosclérose l'artère se durcit le sang est ralentit et sa vitesse est augmentée à la sortie de l'artère phénomène d'hypertension.
Les récepteurs aux LDL se créent à la suite de repas trop riches en graisses, cigarette, alcool. Les HDL-cholestérol récupèrent le cholestérol et l'amène dans le foie où il y a dégradation. D'où l'appellation de bon cholestérol et de mauvais cholestérol.
Les protéines présentent plusieurs rôles : énergétique, structural et fonctionnel.
Energétique : 1g de protides = 17kJ. Toutefois, ce rôle est secondaire. On ne fabrique pas d'énergie à partir de protides sauf au niveau du foie qui fabrique son énergie à partir de protides. Or en cas de jeûne important, l'organisme utilise les protides comme source d'énergie.
Structural : Les protéines interviennent dans la structure de toutes les membranes biologiques. Elles entrent dans la constitution de tous les tissus de l'organisme d'où l'appellation de molécule batisseurs.
Fonctionnel : Les protéines représentent l'activité biologique la plus importante :
Ex : Les enzymes sont de nature protéiques, les médiateurs chimiques, les hormones, les anticorps, l'hémoglobine sont de nature protéique.
Les acides nucléiques sont des molécules de l'information génétique. On les trouve essentiellement dans le noyau des cellules. Il existe 2 types d'acides nucléiques fondamentaux :
Acide désoxyribonucléique (ADN contient du désoxyribose) localisé essentiellement dans le noyau et les mitochondries.
Acide ribonucléiques (ARN contient du ribose) localisé dans le noyau, les ribosomes, le cytoplasme.
ADN et ARN sont des polymères des désoxyribonucléotides (ADN) et de ribonucléotides (ARN)
Unités de base des acides nucléiques. Molécule complexe (association de plusieurs molécules) constituée de 3 molécules de base : ose (en C5), acide phosphoriques, base azotée.
Le ribose est un D-aldopentose
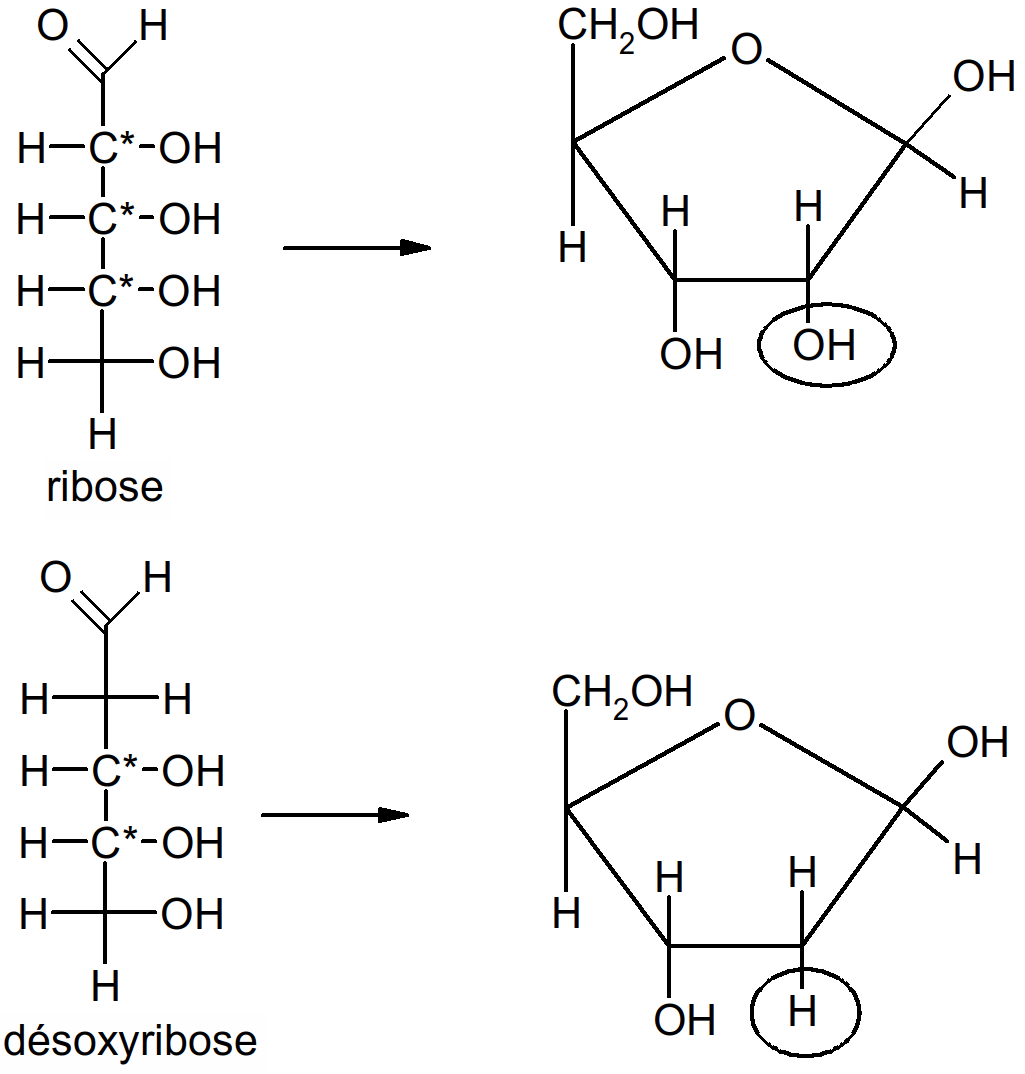
Figure 41 : ribose, désoxyribose et leur cyclisation
Formule brute H3PO4. Présent à la fois au niveau des désoxyribonucléotides et des ribonucléotides.
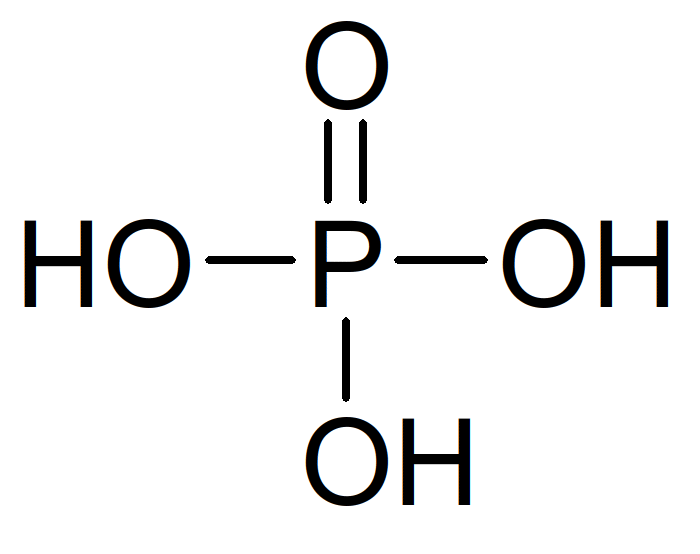
Figure 42 : acide phosphorique
On distingue 2 types : les bases puriques (renfermant un noyau de purine) et les bases pyrimidiques (renfermant un noyau de pyrimidine).
Il existe 2 bases puriques : l'Adénine (A) et la Guanine (G).
Il existe 3 bases pyrimidiques : la Thymine (T), la Cytosine (C), et l'Uracile (U).
Il en existe 4 différents : A, G, C et T
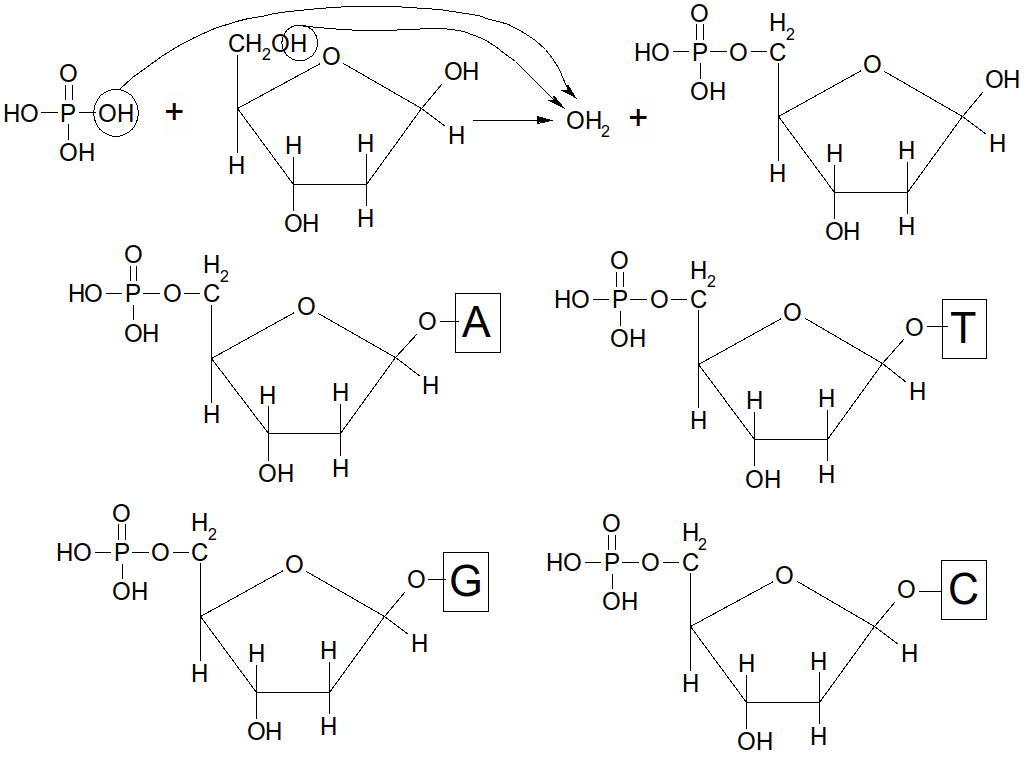
Figure 43 : désoxyribonucléotides

Figure 44 : liaisons des désoxynucléotides
Il en existe 4 différents : A, G, C et U
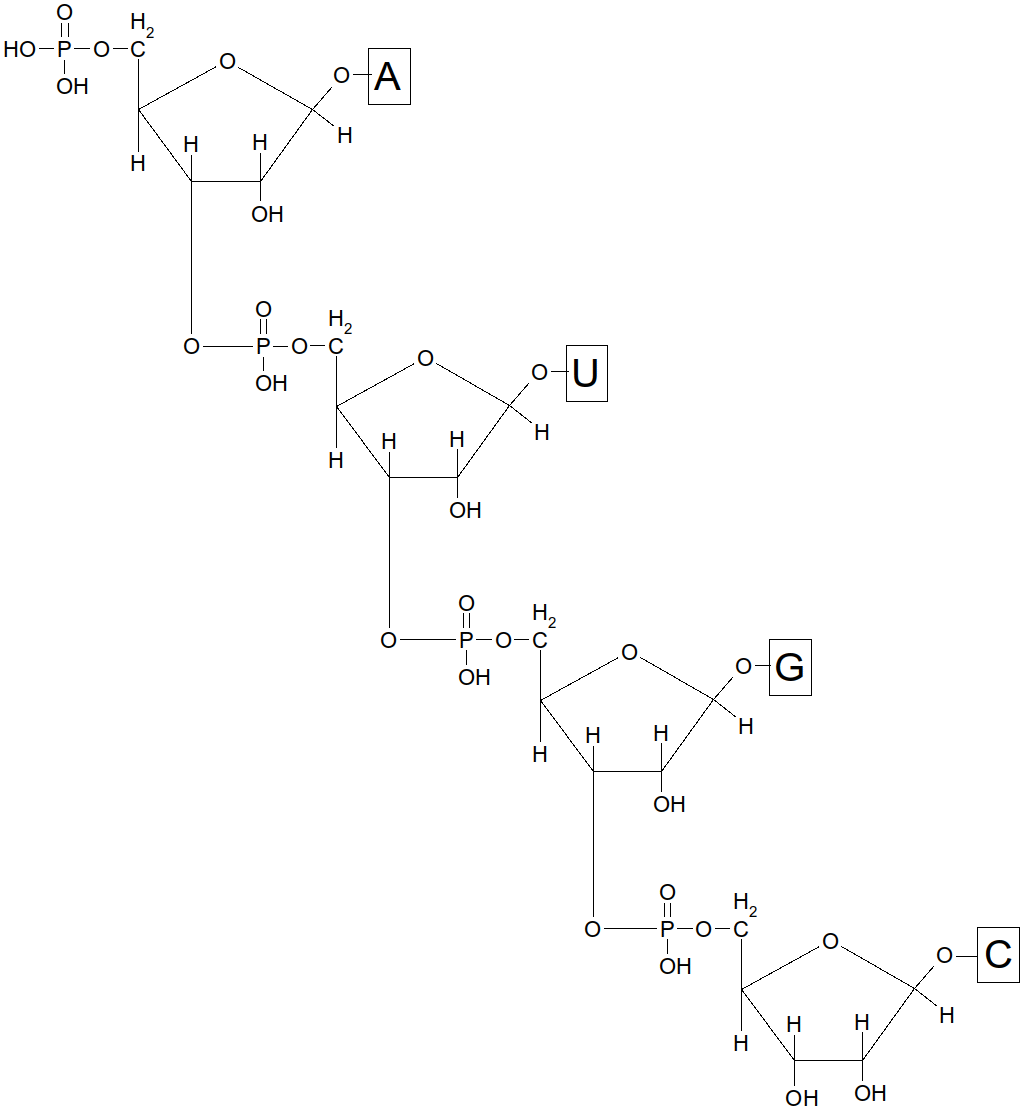
Figure 45 : liaisons des ribonucléotides
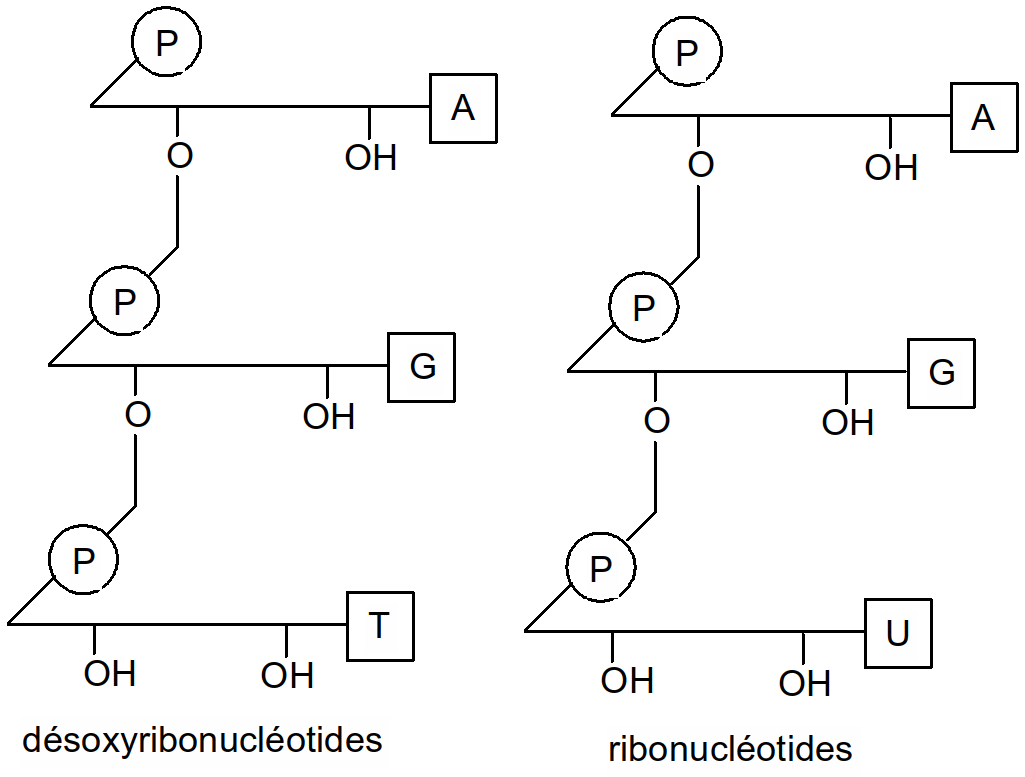
Figure 46 : écritures simplifiées des nucléotides
L'ADN est un polymère de désoxyribonucléotides contenant les bases A, G, T et C. On s'est aperçu que les rapports A/T=1 A=T, G/C=1 G=C et (Base purique)/(base pyrimidique)=(A+G)/(T+C)=1 A+G=T+C, (A+T)/(G+C)≠1.
Des chercheurs ont ainsi pu mettre en évidence la complémentarité des bases azotées : A est toujours associé à T et G est toujours associé à C.
Du fait de cette complémentarité, la molécule d'ADN est constituée de 2 chaînes de polymères de désoxyribonucléotides structure bicaténaire.
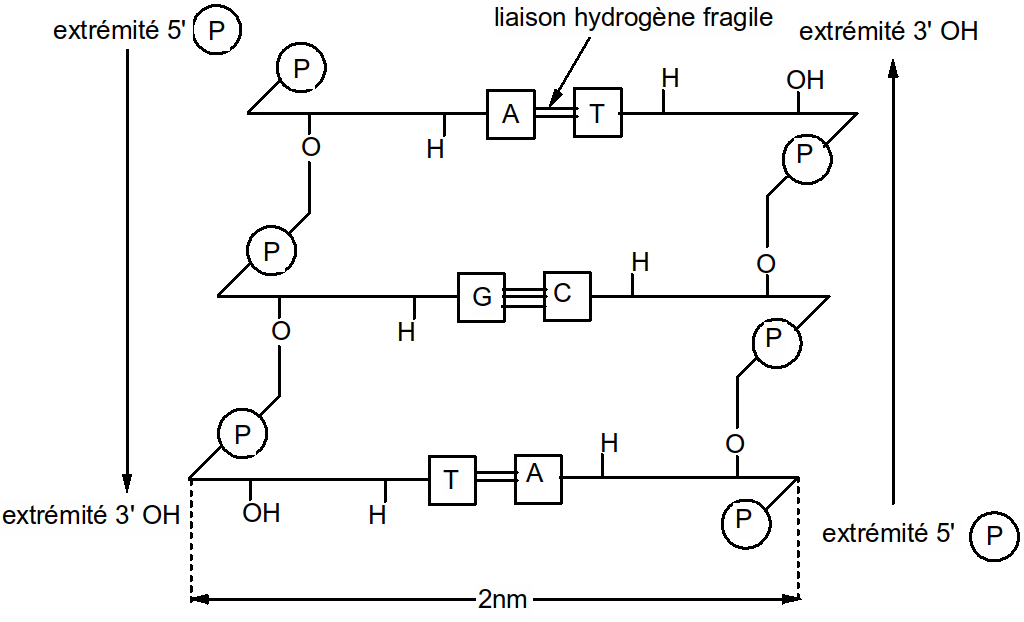
Figure 47 : structure bicaténaire de l'ADN
Dans l'espace, on obtient une double hélice : celle de Watson et Crick (prix Nobel en 1962). L'hélice en spirale est constituée de 10 paires de bases par tour de spire. Chaque paire de base est séparée par 0,34nm.
Schéma de l'ADN.
Polymères de ribonucléotides (A, G, C, U). voir "Figure 46 : écritures simplifiées des nucléotides". La molécule d'ARN est monocaténaire formée d'une seule chaîne. On l'écrit par la succession des bases azotées : 5' A-U-G-G-C-C-A-U 3'
Quelque soit les espèces animales ou végétales : A/T et G/C = 1 toutes les molécules d'ADN sont construites sur le même modèle bicaténaire c'est à dire double hélice de Watson et Crick.
Par contre, lorsque l'on calcule (A+T)/(G+C)≠1 et le rapport est différent suivant l'espèce concernée. Il existe donc une variabilité moléculaire en lien avec l'espèce. La molécule d'ADN contient une information codant pour l'espèce. On parle d'information génétique. C'est à dire quand il y a reproduction, il y a maintien de l'information génétique. Cette transmission s'effectue avec conservation de l'information.
Il existe donc un système permettant de copier l'information sans la détériorer. Ce mécanisme s'appelle la réplication de l'ADN. Cette information génétique codera pour des molécules jouant un rôle structural et fonctionnel ; autrement dit, pour la synthèse des protéines.
La molécule d'ADN est protégée au sein du noyau. Dans celui-ci, elle existe sous deux formes : la forme diffuse (ou dispersée = la chromatine), la forme condensée (= les chromosomes).
Formule chromosomique : 2n=46 chromosomes. Soit 22 paires de chromosomes homologues (autosomes) et 1 paire de chromosomes sexuels.
Ce sont des molécules organiques sans valeur énergétique. Les besoins journaliers sont très faibles. Toutefois, ce sont des molécules jouant un rôle important dans le métabolisme. Elles permettent de nombreuses réactions chimiques. L'organisme est incapable de synthétiser la plupart des vitamines. Il faut donc les apporter par voie alimentaire. On pense que plus d'une dizaine de substances répondent à cette définition des vitamines. Seuls 13 d'entre elles sont particulièrement retenues car d'une part on connaît leurs rôles biologiques et leurs sources alimentaires. Une carence en vitamines peut avoir des effets très graves sur l'organisme pouvant aller jusqu'à la mort.
Ex : avitaminose D rachitisme
Les vitamines sont classées en deux grandes catégories :
Vitamines liposolubles : A, D, E, K
Vitamines hydrosolubles : C, B (B1, B2, B3=PP, B5, B6, B8, B9)
Lettre de la vitamine |
Nom de la vitamine |
|
A |
Rétinol = axérophtol ou provitamine A = carotène |
|
D |
Cholécalciférol = ergocalciférol |
|
E |
tocophérol |
|
K |
Phylloquinone ou métaquinone |
|
B1 |
Thyamine |
|
B2 |
riboflavine |
|
B3 |
Niacine = acide nicotinique |
|
B5 |
Acide pentothénique |
|
B6 |
pyridoxine |
|
B8 |
biotine |
|
B9 |
Acide folique |
|
B12 |
cyanocobalamine |
|
C |
Acide ascorbique |
Tableau 9 : les principales vitamines
Les sources sont exclusivement alimentaires. La teneur en vitamine est variable selon les aliments.
Ex : Cas de la vitamine C :
|
Aliments |
Vitamine C (mg/100g) |
|
Persil |
200 |
|
Poivron |
120 |
|
Citron |
60 à 80 |
|
Orange |
50 à 600 |
|
Chou-fleur |
60 |
|
Mâche |
50 |
Tableau 10 : présence de vitamine C dans les aliments
|
Vitamines |
Besoins journaliers |
|
A |
950 g (≃ 1 mg) dont la moitié en carotène |
|
D |
10 g |
|
E |
12 mg |
|
K |
40 g |
|
B1, B2, B3 |
1 < B < 1,5 mg |
|
B5 |
10 mg |
|
B6 |
2 mg |
|
B8 |
|
|
B9 |
0,5 mg |
|
B12 |
3 g |
|
C |
80 mg |
Tableau 11 : besoins journaliers en vitamines
Les besoins journaliers varient en fonction de l'âge, de la taille, de l'activité, de la situation physiologique (grossesse, allaitement).
Ex : Un nourrisson a besoin d'un apport en vitamines D supplémentaire et ce jusqu'à l'âge de 2 ans. La femme enceinte a un besoin plus important en vitamine C, en complexe vitamine B-A et vitamine D. La femme allaitant a besoin de C, A, D et B9. Le vieillard a un besoin important en vitamine C.
Toutes les vitamines sont à apporter par voie alimentaire. Toutefois, certaines d'entre elles sont issues de transformations organiques.
Ex : vitamine A transformation de la provitamine A c'est à dire carotène. La vitamine K est synthétisée par la flore commensale de l'intestin grêle, c'est à dire par des bactéries qui siègent dans l'intestin. Les vitamines B1, B2, B8 et B12 sont également élaborées par les bactéries intestinales.
Les vitamines apportées par voie alimentaire sont stockées dans toutes les cellules de l'organisme mais principalement dans les cellules hépatiques ( = foie). Une alimentation équilibrée assure l'apport nécessaire en vitamines. De plus, les réserves sont importantes.
Ex : Réserves en vitamine A permettent de résister à une carence de 6 mois. Une réserve en vitamine D permet de résister pendant 2 mois. Toutefois, la carence en vitamine D est rare car celle-ci est issue d'une transformation du 7-déhydrocholestérol par l'action des UV.
Une carence en vitamine C entraîne un rachitisme pouvant évoluer jusqu'à la mort du fait de l'hématurie ( = présence de sang dans les urines), des diarrhées sanglantes.
Une carence en vitamine B3 entraîne une pellagre c'est à dire un œdème accompagné d'un érythème, des aphtes au niveau de la bouche et des muqueuse, desquamation de la peau, troubles psychiques.
Les vitamines sont absorbées au niveau intestinal. Le sang permet de faire circuler les vitamines hydrosolubles. Les vitamines liposolubles sont absorbées par voie lymphatique. Or la lymphe se jette dans la circulation sanguine.
Au niveau du sang il y a plusieurs utilisations :
Soit dans une zone de stockage foie
Soit activation des vitamines (Ex : -carotène transformée en vitamine A)
Soit utilisation des vitamines (Ex : utilisation des vitamines A, K dans le métabolisme énergétique)
Soit trop utilisée inefficace élimination
Les vitamines hydrosolubles sont éliminées dans les urines. Les vitamines liposolubles sont éliminées par les selles.
|
vitamine |
rôle |
|
A |
Intervient dans la croissance Vision nocturne Santé de la peau Résistance aux infections Pouvoir anti-oxydant |
|
D |
Croissance : fixation osseuse du Ca2+ |
|
E |
Anti-oxydant Fonctionnement musculaire et nerveux Fertilité |
|
K |
Coagulation du sang |
|
C |
Anti-fatigue Permet la lutte contre les infections Absorption du Fer Anti-oxydant |
|
B1 |
Système nerveux Fonctionnement cardiaque |
|
B2 |
Fonctionnement cellulaire Santé de la peau en lien avec autre complexes des vitamines B et A |
|
B3 |
Idem B2 |
|
B5 |
Pousse des cheveux Santé de la peau |
|
B6 |
Métabolisme énergétique Différenciation cellulaire fœtale |
|
B9 / B12 |
Lutte contre l'anémie en favorisant l'absorption du Fer en liaison avec la vitamine C. |
Tableau 12 : rôles physiologiques des vitamines
Les réaction d'hydrolyse enzymatique qui nous intéressent sont celles qui se déroule au niveau de l'organisme et en particulier au niveau de l'appareil digestif.
Classification en fonction du lieu d'action (tube digestif : bouche, estomac, intestin grêle/duodénum) ou du substrat (glucides, lipides, protides, acides nucléiques). Les glandes exocrines sécrètent dans le milieu extérieur.
Schéma du tube digestif et des glandes exocrines annexes.
|
substrat |
enzyme |
Agit sur ? |
Agit où ? |
Produit par ? |
|
Glucide |
Amylase |
amidon |
Bouche, duodénum |
Glandes salivaires, pancréas |
|
Invertase ou saccharase |
saccharose |
Jéjuno-iléon |
Intestin grêle |
|
|
Maltase |
maltose |
Jéjuno-iléon |
Intestin grêle |
|
|
Lactase |
lactose |
Jéjuno-iléon |
Intestin grêle |
|
|
Lipides |
lipase |
triglycérides |
duodénum |
Pancréas |
|
Acides nucléiques |
nucléase |
ADN, ARN |
duodénum |
pancréas |
|
protides |
pepsine |
protéines |
estomac |
Estomac |
|
Trypsine, chymotripsine, carboxypeptidase |
polypeptides |
duodénum |
pancréas |
|
|
aminopeptidase |
Oligopeptide : tri ou tétrapeptides |
Jéjuno-iléon |
Intestin grêle |
|
|
dipeptidase |
Dipeptide |
Jéjuno-iléon |
Intestin grêle |
Tous les enzymes digestifs sont des enzymes d'hydrolyse (enzymes qui scindent les macromolécules au niveau de liaisons spécifiques. Ils transforment des macromolécules (aliments) en molécules simples (nutriments). Cette transformation s'effectue au niveau du tube digestif. Le passage au niveau de la barrière intestinale s'appelle l'absorption intestinale.
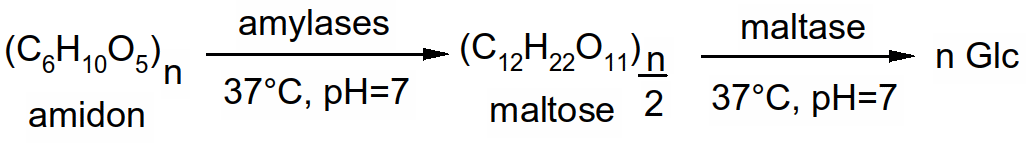
Figure 48 : hydrolyse de l'amidon

Figure 49 : hydrolyse des protéines
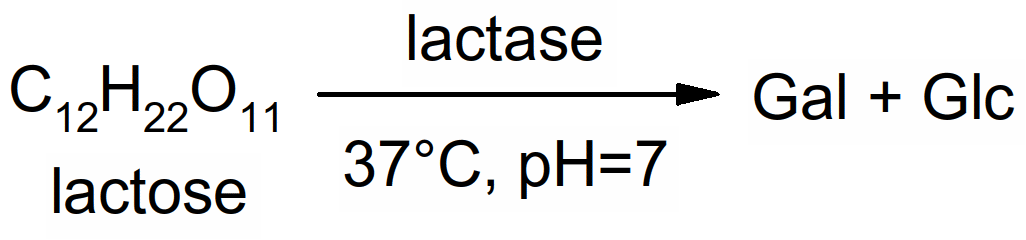
Figure 50 : hydrolyse du lactose
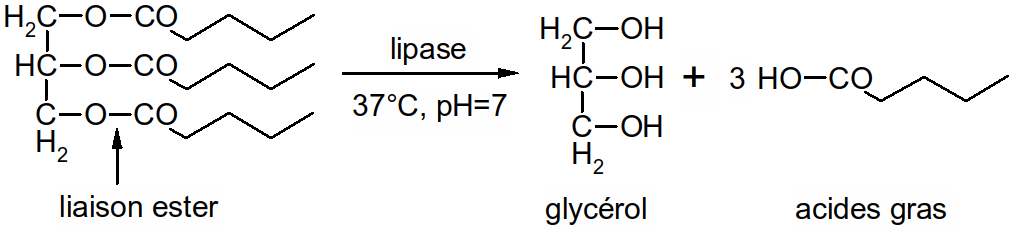
Figure 51 : hydrolyse des lipides
Bibliographie
Biochimie générale – J. –H. WEIL – éditions MASSON – 7ème édition
Biologie humaine, Première et Terminale SMS – Shirley Debacq & Ingrid Fanchon – éditions NATHAN Technique
Terminologie médicale et physiopathologie, SMS – Annie Godrie & Thierry Hervieux - éditions NATHAN Technique
Cours de collègues enseignants en BTS ESF notamment.
Logiciels utilisés pour la réalisation de ce cours :
Logiciel de modélisation moléculaire en 2D
LibreOffice.org le traitement de texte libre et gratuit